 | Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки |
Архив статей > Химия > Опыты без взрывов > В коллекцию реактивов
В коллекцию реактивов
Химия и Жизнь №5, 1982 г., с. 74-75
Несколько лет назад клуб проводил операцию. "Нихром" (№ 10, 1974 год) - юные химики искали наилучший способ разделения, металлов, входящих в состав нихрома. М. РОДЫГИН, десятиклассник из Горловки, получил чистые соли никеля из держателей-токов-водов, к которым крепятся концы вольфрамовой нити в электрических лампочках. Эти держатели изготовляются из платинита - сплава, в котором 42-44% никеля. Несколько держателей (они всегда впаяны в стекло) можно растворить в царской водке или, еще лучше, в концентрированной азотной кислоте с добавкой перекиси водорода (Работать над тягой!). После охлаждения раствор нейтрализуется аммиаком, взятым в избытке. Никель при этом образует растворимый аммиачный комплекс - красивый, сиреневый, а железо выпадает в осадок в виде гидроксида. После фильтрования и упаривания остается смесь нитратов никеля и аммония. Если ее греть, вначале удалится кристаллизационная вода, потом (при 105°С) от нитрата никеля отщепится кислород - получится нитрит, а далее пойдут разлагаться нитрат аммония (190°С) и нитрит никеля (220°). После полного разложения солей, которое, разумеется, нужно тоже проделывать под тягой, останется только оксид никеля.
Соли никеля легко получить из промытого оксида и соответствующих кислот. Пригодятся эти соли, например, для электролитического никелирования металлических изделий.
Константин БОЯНДИН (8-й класс, Семипалатинск) обнаружил, что если натриевую селитру смешать со щавелевой кислотой и слегка нагреть, то получается диоксид азота. Выделяется он настолько легко, что, охлаждая его пары, Константин сумел собрать целую пробирку жидкого димера N2O4, кипящего, как известно, при 21 °С. Взамен щавелевой кислоты можно брать и препарат "Тартрен" - средство от ржавчины. Уравнение реакции юные химики, надо полагать, смогут написать сами. Интересно лишь добавить, что окисление щавелевой кислоты селитрой, если его выполнять в водной среде, идет совсем не так - это установил еще в 1904 году французский химик Дебурдо. В кислой среде в присутствии ванадиевого катализатора получается NO, а без катализатора - "веселящий газ", N2O.
Чистоту N2O4 легко проверить по цвету: если в нем есть примесь N2O3, жидкость окрашивается в сине-зеленый цвет. Напомним, что оксиды азота весьма ядовиты и работать с ними можно только в вытяжном шкафу.
В. БОЧАРОВ из Сочи обратил внимание на то, что юные химики хоть и любят получать кислоты, но почему-то ограничиваются чаще всего соляной или азотной. Между тем фосфорная кислота доступна ничуть не меньше. А опытов с ней можно проделать великое множество, да и в хозяйстве пригодится: ею хорошо снимать ржавчину со стальных изделий перед их окраской.
Фосфорная кислота легко делается из дигидрофосфата натрия (годится и тринатрийфосфат - оба эти вещества продаются в хозяйственных магазинах). Прибор для получения кислоты изображен на рис. При насыщении концентрированного раствора фосфата газообразным хлороводородом в осадок выпадает NaCl, а остается, понятно, Н3РО4.
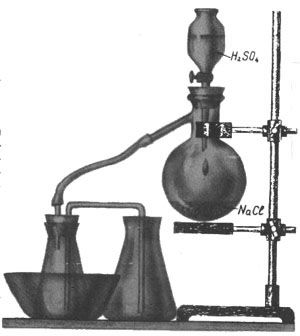
Признак завершения реакции - перебрасывание вещества в последнюю колбу, которая для этого и оставлена пустой. Когда реакция закончится, горелку из-под колбы Вюрца можно убрать, отфильтровать кислоту через кусок стеклоткани и прогреть ее (разумеется, тоже под тягой) для удаления остатков хлороводорода. После этого остается почти чистая ортофосфорная кислота - густая жидкость. Если ее дополнительно упарить, можно выделить и ее кристаллы, плавящиеся при 42°С. В. БОЧАРОВ (он, к сожалению, не сообщил редакции свое полное имя) пишет, что таким способом он обеспечил фосфорной кислотой не только себя, но и весь школьный кружок.
Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки
Помоги сайту! Брось денежку в смс-копилку!