 | Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки |
Архив статей > Химия > Обыкновенный синтез обыкновенного алмаза
Обыкновенный синтез обыкновенного алмаза
Член-корреспондент АН СССР Б. В. Дерягин, доктор химических наук Д. В. Федосеев
Химия и жизнь №10, 1982 г., с. 26-29
Почти 200 лет назад было установлено, что алмаз представляет собой чистый углерод, и с тех пор не прекращались попытки получить этот драгоценный камень искусственным путем. История этих исследований не менее увлекательна, чем история алхимических попыток получить золото из неблагородных металлов; отличие состояло лишь в том, что, как мы теперь знаем, синтез алмаза из графита теоретически возможен, и следовало лишь найти условия, при которых он осуществим практически. Реализовать эту идею удалось лишь в середине нынешнего века: метаморфоза происходит при чудовищном давлении 100 килобар и температуре свыше 3000 К.
Но зачем нужны столь большие давление и температура и нельзя ли получать алмазы в более мягких условиях?
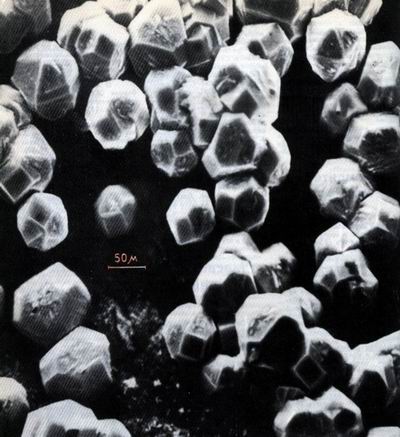
Ограненные кристаллы алмаза, выросшие на поверхности золота из газовой фазы
ТЕРМОДИНАМИКА И КИНЕТИКА
При обычных условиях алмазы кажутся нам вечными и неизменными. А ведь в действительности алмаз представляет собой весьма неустойчивую модификацию углерода и при повышении температуры способен самопроизвольно превращаться в графит.
Какой смысл вкладываем мы в слова "неустойчивая модификация", "самопроизвольное превращение"? Почему такое превращение идет лишь при повышенной температуре? И почему обратный процесс превращения графита в алмаз наблюдается лишь при огромном давлении?
На эти вопросы отвечают термодинамика - наука, исследующая равновесные системы, - и кинетика, наука о скоростях химических превращений.
Представьте себе заснеженный горный склон, по которому скользят лыжники. Вниз они скользят самопроизвольно, но вот чтобы забраться вновь наверх, им нужно затратить немало труда. Чем выше гора, тем труднее лыжнику на нее взобраться и тем меньше находится упрямцев, готовых тратить все больше и больше сил. Видимо, рано или поздно наступит момент, когда все лыжники останутся внизу, и забава прекратится. Именно в этом смысле мы и говорим о термодинамической устойчивости или неустойчивости того или иного состояния: чем больше энергии нужно затратить, чтобы его достичь, тем это состояние оказывается менее вероятным. Так вот, при низком давлении устойчивой модификацией углерода оказывается графит, и лишь при давлении 100 килобар равновесие оказывается заметно смещенным в сторону алмаза, что показал в 1939 году О. И. Лейпунский.
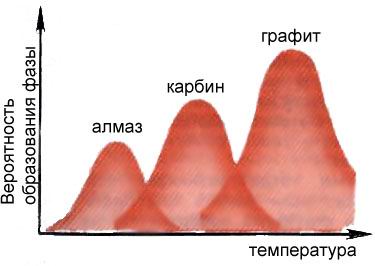
При постоянном давлении максимумы вероятностей образования разных фаз углерода приходятся на разные температуры, что позволяет управлять процессом
Продолжим нашу аналогию. Усложним лыжную трассу: возведем на вершине горы, прямо перед самым началом спуска, барьер. Разумеется, чем выше это дополнительное препятствие, тем труднее будет лыжникам спуститься вниз, тем больше им нужно затрачивать дополнительной энергии. И если этот барьер очень высок, то все взобравшиеся на вершину лыжники уже не смогут спуститься вниз, хотя термодинамически такое состояние системы и окажется крайне неустойчивым. Именно такой кинетический барьер мешает алмазу, неустойчивому термодинамически при низком давлении, самопроизвольно превратиться в графит. Но нагревание сообщает системе дополнительную энергию, за ее счет барьер преодолевается, и система, как и прежде, переходит в термодинамически устойчивую модификацию. И наоборот: при высоком давлении, когда устойчив алмаз, повышение температуры способствует ускорению процесса, который при низкой температуре протекает с ничтожной скоростью.
Из этого следует важный вывод: при желании систему можно перевести в термодинамически неустойчивое состояние, как бы возведя высокий барьер на склоне, но соорудив фуникулер.
Применительно к алмазу это означает, что никакого принципиального запрета на его синтез при низком давлении нет: просто нужно найти условия, при которых этот процесс оказывается более вероятным, чем процесс образования графита, чтобы возникшие частицы алмаза не превращались сразу в графит и чтобы неизбежно образующийся графит не мешал дальнейшему росту алмаза.
СТРУКТУРА ПО НАСЛЕДСТВУ
Первых успехов в этом направлении удалось добиться, используя метод так называемой эпитаксии - наращивания поверхности уже готового алмазного кристалла атомами углерода, образующимися в результате термического разложения газообразных углеводородов вроде метана или ацетилена. В этом случае поверхность кристалла служит как бы матрицей, на которой под действием поверхностных сил штампуются такие же кристаллические слои. Можно сказать, что эпитаксиальный синтез заключается как бы в наследовании осаждаемыми слоями первоначальной структуры подложки.
Эпитаксиальный синтез алмаза (точнее, автоэпитаксиальный, поскольку в этом случае алмаз растет на алмазе) удалось осуществить, используя как крупные монокристаллы алмаза, так и алмазный порошок. В последнем случае явление особо наглядно: поскольку алмазный порошок обладает большой удельной поверхностью (до 10 м2/г), за кинетикой процесса можно следить, просто взвешивая время от времени образец - скорость прибавки его массы характеризует скорость осаждения алмаза на микрокристаллах.

Структура растущей алмазной пленки
Естественно, что осаждению алмазной модификации углерода сопутствует осуждение графита; когда же поверхность алмазной подложки полностью графитизируется, рост алмазной пленки прекращается и из газовой фазы продолжает выделяться только графит. Роль, которую играет структура алмазной подложки, продемонстрировали опыты, когда в ней преднамеренно (с помощью g -облучения) создавались микроскопические дефекты: в этом случае графитизация поверхности заметно ускорялась и вновь замедлялась после залечивания радиационных дефектов путем отжига.
На этом этапе исследований удалось получить первую информацию о самом химическом механизме роста алмаза из газообразных углеводородов. Было замечено, что когда углеводород разбавлялся молекулярным водородом, то скорость его разложения, как и следовало ожидать, уменьшалась, но при этом скорость образования графита уменьшалась в несколько раз сильнее, чем скорость образования алмазного слоя. Было известно, что при взаимодействии метана СН4 с молекулярным водородом могут возникать две разновидности частиц - свободные радикалы СН3· и молекулы соединения СН5. Оказалось, что графит образуется при дальнейшем распаде радикалов, в алмаз - при распаде молекул СН5 на поверхности кристалла: примесь водорода подавляет рождение свободных радикалов, но способствует появлению частиц СН5.
Еще более интересные результаты дало применение атомарного водорода. Для этого смесь метана или другого углеводорода пропускалась через плазму тлеющего разряда, а затем направлялась на ту или иную поверхность, на которой и выделялся элементарный углерод. Но выделялся только в виде алмаза, потому что, как выяснилось, частицы графита легко взаимодействуют с атомарным водородом и удаляются из зоны реакции.
Эти исследования, выполненные В. П. Варниным, показали также, что атомарный водород позволяет применять в качестве подложки не только алмаз, но и другие материалы. Так, удалось получить алмазные пленки, покрывающие поверхность молибдена, рения, кремния. Алмазные пленки и даже ограненные монокристаллы алмаза были получены Б. В. Спициным с помощью химических транспортных реакций, когда углерод доставлялся к месту синтеза алмаза в виде углеводородных радикалов.
В. М. Голянов разработал метод получения алмазоподобных пленок из потоков нейтральных атомов углерода. Этот метод заключается в том, что между графитовыми электродами, помещенными в среду сильно разреженного инертного газа, зажигается электрический разряд, и образующиеся в результате распыленш материала электродов нейтральные атомы углерода направляются на подложку, охлаждаемую жидким азотом. Образующиеся при этом пленки названы алмазо-подобными потому, что представляют собой аморфную модификацию алмаза: в этой модификации связи между атомам" углерода имеют ту же длину, что и в алмазе, но характерный для кристалла строгий геометрический порядок размещения атомов отсутствует. Вместе с тем по многим важным свойствам алмазоподобные пленки очень похожи на алмазные.
Наконец, нельзя не упомянуть о методе получения алмазных пленок осаждением углерода из ионных пучков, разработанном группой сотрудников Харьковского физико-технического института. В этом случае поведением атомов можно управлять с помощью электрического поля, в результате чего алмазные покрытия удалось нанести на стекло, металлы, полимеры То есть в этом случае подложка оказывается просто геометрическим местом роста алмаза.
Но тогда возникает естественный вопрос: если можно подобрать условия когда структура поверхности, на которой из газовой фазы растет алмаз, не играв никакой роли, то нельзя ли вообще отказаться от подложки? Иными словами, нельзя ли синтезировать алмаз непосредственно в газовой фазе?
АЛМАЗНАЯ ПЫЛЬ
В "Основах химии" Д. И. Менделеева читаем: "Органические вещества, сгорающие при недостаточном притоке воздуха, выделяют сажу, т. е. уголь, происшедший из парообразных водородистых соединений углерода, из которых при горении водород образует воду". И там же: "Если взять органическое вещество летучее, например, газообразное соединение, содержащее углерод и водород, то уголь выделяется из такого вещества, если пропустить его пар через сильно накаленную трубку". Так почему при распаде углеводородов углерод выделяется в виде сажи, а не алмаза?
Всем должно быть хорошо известно явление, когда пересыщенный раствор мгновенно кристаллизуется после внесения в него затравки - крошечного кристаллика того же самого вещества. Как и в случае эпитаксии, поверхность кристаллика служит как бы матрицей, на которой происходит наращивание твердой фазы; только в отличие от эпитаксии кристаллизация происходит самопроизвольно.
Но затравкой может служить не только твердая частичка растворенного вещества; кристаллизацию может вызвать и любая пылинка, если только игра случая создала на ее поверхности участок, хоть отдаленно напоминающий структуру кристалла. Наконец, затравочный кристаллик может образоваться в пересыщенном растворе и самопроизвольно - если несколько частиц растворенного вещества случайно сблизятся в подходящей конфигурации. При разложении углеводородов сначала тоже образуется пересыщенная - только газообразная - фаза углерода, и его дальнейшая судьба зависит только от того, на какой зародышевый центр он начнет осаждаться. В обычных условиях наиболее вероятно самопроизвольное образование частичек сажи; но не равна нулю и вероятность самопроизвольного зарождения частичек алмаза. И если научиться управлять процессом образования зародышей, то результатом разложения углеводорода может оказаться алмазная пыль - микроскопические алмазные частички.
Поначалу эта идея казалась совершенно фантастической - тем более, что теоретический анализ явления был крайне затруднен, а поиск вслепую мог затянуться на многие десятилетия. Тем не менее даже грубые качественные теоретические оценки дали неожиданный результат: оказалось, что должны существовать условия (подходящие температура и давление), когда можно ожидать преимущественного образования алмазных зародышей.
Экспериментальные исследования в этом направлении были начаты почти одновременно в трех институтах: Институте физической химии АН СССР, Институте проблем материаловедения АН УССР, Институте сверхтвердых материалов АН УССР. Разные группы исследователей применяли различные методы разложения углеводородов - лазерный нагрев, электрические разряды, взрыв. При этом для того, чтобы предотвратить самопроизвольное превращение алмаза в графит, образующиеся частички алмазного аэрозоля приходилось быстро удалять из зоны реакции и охлаждать, для чего разные исследователи прибегали к разным ухищрениям.
Образующийся микрокристаллический порошок содержал практически все кристаллические модификации углерода: не только алмаз, но и графит, и карбины. Но примеси удается отделить от алмазного порошка и получить в чистом виде вещественное доказательство нашей правоты.
Разработанные методы синтеза алмаза в области его термодинамической нестабильности имеют не только огромное научное значение; уже сейчас можно говорить о практических результатах этих исследований. И дело не в том, что можно обходиться без огромных давлений, а в том, что эти методы позволяют решать уникальные задачи. Так, эпитаксиальное осаждение может служить методом улучшения абразивных свойств алмазных порошков, а также предварительной стадией их обработки перед спеканием; алмазные пленки перспективны для изготовления покрытий рабочих поверхностей режущего инструмента, элементов радиоэлектронных устройств и контактирующих пар с малым коэффициентом трения.
Надо надеяться, что этим методам найдутся и иные перспективные области применения.
ЧТО ЧИТАТЬ О СИНТЕЗЕ АЛМАЗОВ ИЗ ГАЗОВОЙ ФАЗЫ
Безрукое Г. Н., Бутузов В. П., Самойлович М. И. Синтетический алмаз. М.: Недра, 1976.
Дерягин Б. В., Федосеев Д. В. Рост алмазов и графита из газовой фазы. М.: Наука, 1977.
Дерягин Б. В., Федосеев Д. В. Алмазы делают химики. М.: Педагогика, 1980.
Федосеев Д. В., Чужко Р. К., Гривцов А. Г. Гетерогенная кристаллизация из газовой фазы. М.: Наука, 1978.
Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки
Помоги сайту! Брось денежку в смс-копилку!