 | Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки |
Архив статей > Химия > Когда аргон подобен калию
Когда аргон подобен калию
Доктор физико-математических наук А. В. Елецкий
Химия и жизнь №10, 1982 г., с. 30-34
Современные представления о молекулах одинаково прочно утвердились и в физике, и в химии. Ожидать существенного изменения наших взглядов на молекулу как на стабильную систему близко расположенных атомов, связанных между собой силами взаимного притяжения, не приходится. Тем не менее по мере накопления фактов наши представления о структуре и свойствах, о самой природе молекул несколько изменяются. Открытие соединений благородных газов, например, привело к пересмотру понятия валентности. "Химия и жизнь" об этих работах писала (см., в частности, интервью с Н. Бартлеттом в № 2 за этот год).
Мы хотим рассказать о другом не совсем обычном направлении физической химии молекул - химии возбужденных состояний и о так называемых эксимерных молекулах, образованных, пусть на очень короткое время, атомами с возбужденными электронами.
ТОЛЬКО В ВОЗБУЖДЕННОМ СОСТОЯНИИ
Для того чтобы ответить на вопрос, может ли существовать соединение, составленное из атомов двух или нескольких элементов, необходимо знать, как и на каких расстояниях могут взаимодействовать атомы.
Простейший случай: молекула составлена лишь из двух атомов. Если расстояния между атомами не больше и не меньше некоей допустимой величины, а сами атомы испытывают при этом взаимное притяжение, молекула может существовать. Причиной взаимного притяжения может быть, например, электростатическое взаимодействие отрицательно заряженных электронов одного атома с положительно заряженным ядром другого атома. Однако при сильном сближении таких атомов начинается своего рода отторжение: в соответствии с законом Кулона одноименно заряженные ядра отталкиваются, и это ядерное взаимонеприятие исключает возможность образования молекул. Лишь в сравнительно узкой области расстояний, где силы притяжения и отталкивания взаимно уравновешивают друг друга, атомы образуют устойчивое сочленение, которое мы привыкли называть молекулой.
Нагляднее всего (великая наука - геометрия!) характер взаимодействия атомов можно показать на графике зависимости потенциальной энергии взаимодействия от расстояния между атомами. Если молекула стабильна (рис. 1), кривая имеет характерный минимум, своего рода "потенциальную яму". Когда расстояние между атомами близко к оптимальной величине (точка r0), любое изменение вызывает силы, которые стремятся возвратить атомы к исходной равновесной конфигурации. Именно на таком расстоянии, соответствующем дну потенциальной ямы, и находятся обычно атомы в стабильной молекуле.
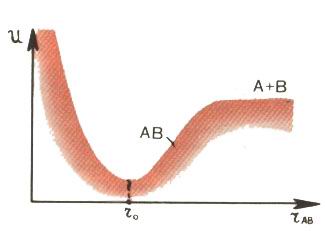
Рис. 1. Зависимость энергии взаимодействия U от расстояния rАВ между атомами, образующими стабильную двухатомную молекулу. Точка r0 соответствует минимуму потенциальной энергии
Совсем другой вид у зависимости потенциальной энергии от межатомного расстояния в тех случаях, когда пара атомов не образует химического соединения (рис. 2). Такие атомы испытывают взаимное отталкивание при любых расстояниях между ядрами. Монотонно убывающая кривая отражает потенциал взаимодействия между такими, например, парами атомов, как Аr - F, Кr - Cl, Хе - Br, a также парами атомов благородных газов. Они не могут образовать двухатомных молекул, подобных N2 или О2.
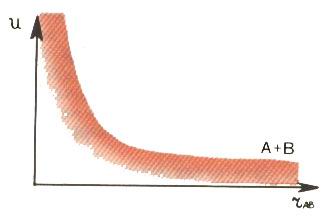
Рис. 2. Монотонно убывающая зависимость U от rАВ описывает взаимодействие атомов, которые не образуют химической связи. Атомы испытывают взаимное отталкивание при любых расстояниях
Как известно, способность атома вступать в химические реакции зависит прежде всего от состояния его внешних электронов. Энергия связи электрона в атоме и квантовые числа, определяющие ориентацию электрона в пространстве, характеризуют эту способность. Опытный химик, зная эти параметры, уверенно скажет вам, соединения какого типа образует данный атом, в каких условиях он проявляет свойства окислителя, а когда может служить восстановителем, насколько прочны его связи с другими атомами и т. д.
Заполненные внешние оболочки и электроны, не переходящие в "коллективное пользование", - вот причины инертности благородных газов. Это хрестоматийно. Но ведь переходу электрона от атома благородного газа к другому атому или в "коллективное пользование" препятствует не что иное, как закон сохранения энергии: слишком много энергии приходится тратить на отрыв электрона от такого атома. В условиях, типичных для проведения химических реакций, атому просто негде взять так много энергии. Но...
В изолированном атоме, свободном от внешних воздействий, электрон находится в основном состоянии. Возбудить электрон может лишь энергия, принесенная извне. Возможны разные степени возбуждения в зависимости от величины привнесенной энергии. Значит, и возбужденных состояний может быть великое множество. Но, заметим, в любом из них электрон может находиться лишь ограниченное время, обычно исчисляемое миллионными, а то и миллиардными долями секунды. Атом, в котором есть хотя бы один возбужденный электрон, называют возбужденным.
Поскольку параметры внешнего электрона в возбужденном атоме отличаются от параметров такого же электрона в основном состоянии, то химические свойства возбужденного атома должны быть не такими, как у невозбужденного. Одни и те же атомы в разных степенях возбуждения могут проявлять себя совсем по-разному. Нетрудно представить, насколько шире стали бы рамки традиционной химии, если бы она смогла охватить соединения, образующиеся при участии возбужденных атомов.
Химические процессы с участием столь короткоживущих частиц уже стали реальностью. Конечно, малые времена жизни возбужденных атомов накладывают определенные ограничения. Главное, скорость реакций с их участием должна быть достаточно большой, иначе реакция либо не успеет произойти, либо наши приборы не успеют ее зарегистрировать. И все же химия возбужденных атомов уже существует и, более того, начинает приносить практическую пользу.
ПРИОБЩЕНИЕ К ВЗАИМОДЕЙСТВИЮ
Наиболее радикальное изменение химических свойств при переходе от невозбужденного состояния к возбужденному происходит с атомами благородных газов. Атом аргона, к примеру, в возбужденном состоянии может стать сильным восстановителем.
Атомы щелочных металлов, имеющие во внешней оболочке по одному s-электрону, проявляют примерно одинаковые химические свойства, известные любому старшекласснику. В атоме инертного газа один из валентных электронов можно возбудить таким образом, чтобы сложилась ситуация, во многом аналогичная той, что имеет место в невозбужденном атоме щелочного металла: валентный электрон находится в s-состоянии (иначе говоря, в первом возбужденном состоянии). Так же, как в атоме щелочного металла, энергия связи этого электрона равна 4-5 эВ.
Атом аргона в первом возбужденном состоянии должен с точки зрения химии быть подобен невозбужденному атому ближайшего из щелочных металлов - калия. То же и в других подобных парах: неон-натрий, криптон-рубидий, ксенон-цезий.
Это сходство сначала было предсказано на основе законов и формул квантовой химии, а потом подтверждено в экспериментах. Были получены молекулы-эксимеры ArF, KrF, XeCl, KrCl.
На рис. 3 в качестве примера представлена диаграмма потенциальной энергии эксимерной молекулы KrF. Естественно, в основном состоянии такая молекула нестабильна, а потому нереальна. Это видно и на графике: с увеличением расстояния между атомами потенциальная энергия взаимодействия монотонно убывает. А на диаграмме такой же молекулы в возбужденном состоянии имеется глубокая потенциальная яма. Значит, в этом состоянии эксимерная молекула может существовать, вступать в реакции, проявлять себя как некая химическая индивидуальность.
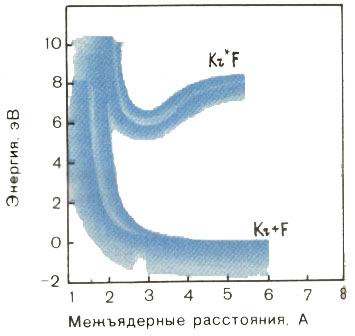
Рис. 3. Потенциальные кривые молекулы KrF. Для основного электронного состояния кривая имеет вид монотонно убывающей функции - молекула в этом состоянии нестабильна. Возбужденная молекула (эксимер) Kr*F имеет кривую с довольно глубоким минимумом, который обусловлен кулоновским притяжением разноименных ионов Кr+ и F-
Уже твердо установлено, что химическая связь в эксимерных молекулах галогенидов благородных газов - ионная, как в привычных молекулах солей. При сближении двух атомов внешний электрон возбужденного благородного газа "перетекает" на атом галогена. В результате образуется пара ионов с зарядами противоположного знака. Кулоновское притяжение этих ионов и удерживает молекулу в стабильном состоянии. Аналогия между солями и эксимерными соединениями очень близкая, на ее основе точно определены энергии связи и многие другие параметры эксимерных молекул. Поэтому их стало легко опознавать в любых, сколь угодно сложных экспериментальных условиях.
Параллель с атомами щелочных металлов позволяет надежно предсказывать свойства неизвестных эксимерных молекул, Советский исследователь В. Д. Кулагин, пользуясь этой аналогией, в 1978 г. предсказал существование сложных эксимерныи молекул типа R*OH (R* - возбужденный атом благородного газа). Одно из таких соединений - эксимерное основание состава Хе*ОН - через несколько месяцев после этого было получено английским исследователем М. Хатчинсоном. Энергия связи и характеристики излучения, сопровождающего распад такой эксимерной молекулы, с точностью до 7% совпал с предсказанными В. Д. Кулагиным.
Поиски новых эксимерных соединений продолжаются во многих лабораториях мира.
ГАРПУННЫЕ РЕАКЦИИ
Поскольку эксимерные молекулы существуют чрезвычайно короткое время накапливать их можно лишь как продукт чрезвычайно скоротечных химических реакций. Таких реакций известно не так yж много, но есть среди них хорошо изученные и простые, например реакции образования галогенидов благородных газов, протекающие при парных столкновениях:
R* + X2 ® R*X + X.
Здесь, как и ранее, R* - возбужденны: атом благородного газа, Х2 - молекула галогена (F2, Cl2, I2).
Скорость этой реакции, как и скорость аналогичной реакции с участием обычных атомов щелочного металла, чрезвычайно высока. В оптимальных условиях большинство возбужденных атомов успевает вступить в реакцию за стомиллионные доли секунды.
Реакция протекает в две стадии (рис. 4). На первой электрон покидает возбужденный атом благородного газа и переходит к молекуле галогена: вместо пары нейтральных частиц образуются два иона с зарядами противоположного знака. Кулоновское притяжение этих ионов заставляет их приблизиться друг к другу на такие расстояния, при которых ионная связь R+ - X- оказывается сильнее, чем связь X - X-. Вторая стадия: разрыв старой - ковалентной и образование новой - ионной связи. Реакция произошла. По образному выражению американского физикохимика Д. Гершбаха, электрон возбужденного атома благородного газа действует здесь подобно гарпуну, который "забрасывается" атомом в электроотрицательную молекулу и с помощью сил электростатического притяжения удерживает реагирующие атомы на близком расстоянии в течение времени, достаточного для перестроения тяжелых частиц, участвующих в химической реакции. Сравнение оказалось настолько точным, что термин "гарпунные реакции" закрепился в научной литературе.
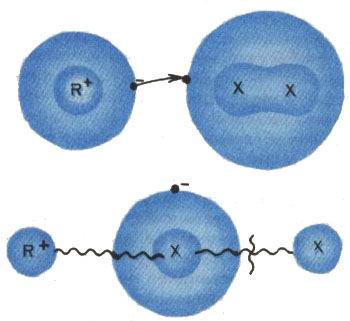
Рис. 4. Гарпунная реакция протекает в две стадии. На первой стадии (а) электрон атома инертного газа, находящегося в возбужденном состоянии, перескакивает на свободную орбиту отрицательного молекулярного иона (Х2)-. На второй стадии (б) кулоновское притяжение положительного (R+) и отрицательного (Х-) ионов приводит к разрыву старой, ковалентной связи Х- - X и образованию новой, ионной связи R+ - Х-.
В наши дни возможно получение эксимерных молекул в больших количествах. Дело, в принципе, сводится к получению возбужденных атомов благородного газа и концентрированию их в тех или иных условиях.
ЕСТЬ ЕЩЕ И ДИМЕРЫ
Галогениды благородных газов - не единственный уже известный класс эксимерных молекул. Не менее интересны димеры благородных газов - молекулы, составленные из двух одинаковых атомов (подобно молекулам азота, хлора, кислорода). Одинаковых, да не совсем: хотя бы один из атомов пары обязательно должен находиться в возбужденном cостоянии. Попробуем разобраться в природе химической связи таких молекул. Рассмотрим для начала более простую систему - молекулярный ион благородного газа (Аr2+, Хе2+ и т. д.). Относительная стабильность таких молекулярных ионов вполне объяснима, поскольку ион, заряженный положительно, немного смещает в свою сторону электронное облако, окружающее нейтральный атом. В результате атом перестает быть сферически симметричной системой и приобретает дипольный момент. Взаимодействие такого диполя с положительным зарядом иона приводит к притяжению, в результате которого на потенциальной кривой появляется необходимый нам минимум - условие относительной стабильности молекулярной системы.
Добавим теперь к молекулярному иону слабосвязанный электрон - ион превратится в димерную молекулу. Орбита слабосвязанного электрона удалена от обоих ядер гораздо дальше, нежели ядра друг от друга.
В реальных условиях, как и в случае с галогенидами, необходимо сначала создать некоторое количество возбужденных атомов благородного газа R*. Молекула R*2 образуется при одновременном соударении трех частиц, одна из которых - возбужденный атом благородного газа: R* + 2R ® R*2 + R. Третья частица необходима, чтобы унести избыток энергии, высвобождающейся при образовании молекулы-димера.
И в этом случае скорость процессов обязательно должна опережать скорость распада возбужденных частиц. Вероятность тройных столкновений тем больше, чем больше давление газа. Для образования эксимерных димеров потребовались очень высокие давления. В первом эксперименте, выполненном в ФИАНе в 1970 г. под руководством академика Н. Г. Басова, димер ксенона удалось получить лишь при работе со сжиженным газом. В дальнейшем, однако, подобные эксимерные молекулы смогли получить и в газообразной среде.
ФАБРИКА ЭКСИМЕРОВ
Естественно, что при получении эксимерных молекул используется не столько химическая, сколько физическая аппаратура. Первая задача, если помните, накопить в плотном газе электронно-возбужденные атомы.
Тут две сложности. Во-первых, возбужденные атомы надо создавать быстро. Во-вторых, совершенно необходимо, чтобы подавляющая часть их находилась в одном и том же возбужденном состоянии, одном из множества возможных. В противном случае одновременно будут идти самые различные процессы, и тогда попытка разобраться в них, выделить что-то одно была бы равносильна попытке исследовать, скажем, реакцию окисления азота во время лесного пожара.
Соблюсти одновременно эти два условия очень непросто. В конечном счете для "фабрики эксимеров" понадобилась не совсем традиционная техника введения энергии в плотный газ - пучок быстрых электронов, сформированный в небольшом линейном ускорителе. Через тонкую фольгу короткими импульсами электроны подаются в объем, заполненный газом под давлением (рис. 5). В плотном газе электрон замедляется в результате многократных соударений. Энергия, выделяющаяся при этом, идет в основном на ионизацию частиц, т. е. вместо необходимых нам возбужденных атомов образуются ионы и свободные электроны.
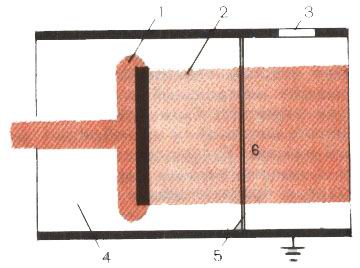
Рис. 5. Схема установки для получения эксимерных молекул с помощью электронного пучка: 1 - катод, на который подается высокое напряжение; 2 - электронный пучок; 3 - окно для наблюдения; 4 - вакуумная камера; 5 - разделительная фольга; 6 - камера высокого давления
Однако если плотность газа достаточно велика, то под действием электронного пучка частицы испытывают серию последовательных превращений, которые в конечном счете приводят к образованию атомов, возбужденных определенным образом. Первое возбужденное состояние атомов благородных газов в этом случае вполне достижимо.
ЗАЧЕМ НУЖНА ХИМИЯ МГНОВЕНИЙ
Эксимерные молекулы, время жизни которых исчисляется мгновениями, вряд ли когда-нибудь понадобятся для получения новых материалов. Срок службы таких материалов исчислялся бы теми же долями миллисекунды, которые "живет" возбужденный атом. И тем не менее роль эксимеров не сводится к утилитарно-рекламной функции - поразить чье-то воображение и еще больше утвердить нас в мысли о бесконечном многообразии явлений природы.
Разумеется, мы никогда не сможем употребить столь короткоживущие молекулы в привычных целях, однако мы в состоянии использовать, практически использовать, сам факт быстрого распада таких молекул. Энергия-то и в этом случае выделяется, причем в чрезвычайно полезном для нас виде: распад эксимерных молекул сопровождается испусканием ультрафиолетового излучения.
До появления эксимерных соединений трудно было получить интенсивное и концентрированное ультрафиолетовое излучение. Обычные источники ультрафиолета отличаются очень низким к. п. д. - считанные проценты энергии, подводимой к устройству, превращаются в кванту излучения с необходимой длиной волны. К тому же это излучение обычно "размазано" по весьма широкому спектральному диапазону: оно состоит из квантов, сильно отличающихся по частотным характеристикам. Распад эксимеров, напротив, дает мощное и практически монохроматическое ультрафиолетовое излучение. Такой ультрафиолет необходим специалистам многих областей науки, в том числе и химии. Эксимерные молекулы представляю собой идеальную активную среду для газовых лазеров, излучающих в ультрафиолетовой части спектра. У эксимерных лазеров возможна плавная регулировка частоты испускаемого излучения. Если лазер, работающий на энергетически переходах обычных молекул, можно сравнить с приемником радиотрансляционной сети с несколькими фиксированными программами, то эксимерный лазер - это первоклассный радиоприемник с точной настройкой на любую волну заданного диапазона.
Такая возможность особенно ценится когда лазерное излучение используют для стимулирования (или исследования) химических реакций. И это лишь один - самый очевидный - практический исход химии мгновений.
Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки
Помоги сайту! Брось денежку в смс-копилку!