 | Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки |
Архив статей > Химия > Водород: именитые изотопы
Водород: именитые изотопы
В. И. Кузнецов
Химия и Жизнь №1, 1981 г., с. 36-43
В 1895 году Герберт Уэллс в романе "Машина времени" описал картину эволюции Солнца так, будто видел ее своими глазами. Строки из романа: "Я продолжал передвигаться по времени..., наблюдая в состоянии какого-то гипноза, как в западной части неба Солнце становится все огромнее и тусклее... Наконец, больше чем через тридцать миллионов лет громадный красный солнечный купол заслонил собой десятую часть потемневших небес..."
В то время законы бытия и развития звезд еще не были известны ни ученым, ни тем более писателям-фантастам. И все же Уэллс угадал: именно так, по современным представлениям, будет меняться облик нашего светила по мере выгорания в его чреве важнейшего из элементов Вселенной - водорода.
СИНТЕЗ
Солнечный водород расходуется во многих процессах. Главный из них - протон-протонная реакция - начинается синтезом ядра изотопа водорода с массовым числом два. Такое ядро называют дейтроном, а атомную конструкцию из одного протона, одного нейтрона и одного электрона вокруг ядра - атомом дейтерия. Атом как атом. Ядро как ядро, рожденное в ходе термоядерного синтеза, стабильное, не испускающее каких-либо излучений. Но вот вопрос: откуда берется в нем нейтрон? Ведь дейтрон рождается в протонной среде.
В разогретой до миллионов градусов сердцевине Солнца много быстрых протонов, способных преодолеть взаимное отталкивание и соприкоснуться друг с другом. Но почти всегда после столкновения протоны просто разлетаются в стороны, не связываясь друг с другом. Лишь в редких случаях в миг такого столкновения один из протонов (p) становится нейтроном (n), и тогда две частицы могут слиться. Из слитка мгновенно вылетает нейтрино (v), и рождается нейтрон-протонная гантель - дейтрон (d).
Внешне все просто. Однако ни в одной земной лаборатории никто не пытался получить дейтерий подобным, естественным в общем-то путем. Исключительно изящный и точный квантовомеханический расчет убеждает в бессмысленности такого занятия. Даже в солнечном веществе, где протоны очень часто сталкиваются между собой, только раз за десятки миллиардов лет у каждого из них возникает реальный шанс превратиться в дейтерий.
Лишь потому, что недра Солнца насыщены водородом, а масса светила огромна, протон-протонная реакция протекает на Солнце достаточно интенсивно. Тем не менее концентрация дейтерия в солнечном веществе мизерна. В условиях Солнца дейтрон живет недолго. Всего через несколько секунд после появления он гибнет, перестает быть дейтроном, заглотив близкий протон и превратившись в ядро гелия.
Невелика доля дейтерия и в земном водороде. Именно по этой причине тяжелый изотоп водорода открыт сравнительно недавно и обнаружен не совсем обычным способом.
БЫВАЮТ ЖЕ СОВПАДЕНИЯ!
В ноябре 1919 г. был завернут последний болт и тело нового масс-спектрометра - точнейших атомных электромагнитных "весов". Новый прибор не обманул надежд его создателя - английского физика Ф. Астона: методом масс-спектрометрии было доказано существование изотопов стабильных элементов. В первые же дни опытов Астон подтвердил наличие обнаруженных Томсоном двух форм неона с атомными весами 20 и 22, а спустя две недели установил изотопный состав хлора и ртути. На основе полученных данных было сформулировано правило: величины атомных масс элементов должны быть близки к целым числам. А нецелочисленные величины атомных масс, определенные химиками, - это результат усреднения целочисленных атомных весов различных изотопов одного элемента.
Массовые числа изотопов водорода должны быть по правилу целых чисел равны одному, двум, трем... Но мы-то знаем: атомная масса водорода - 1,00794. Это современные данные, а тогда, в двадцатые годы, на усовершенствованном масс-спектрометре было получено число 1,00777, прекрасно, кстати, совпадавшее с прецизионными определениями атомной массы водорода химическими методами - 1,00778.
Но, позвольте, скажет читатель, знакомый с азами масс-спектрометрии, на масс-спектрометре измеряют массу одного изотопа, а химическим способом находят среднюю массу их естественной смеси. Если для водорода цифры, полученные физиками и химиками, практически совпадали, то, значит, у этого элемента только один изотоп. Все верно: данные совпадали, и Астон счел водород моноизотопным, простым элементом. Но мы-то знаем, что это не так...
В 1929 г. были открыты тяжелые изотопы кислорода 17О и 18О. До того предполагалось, что и кислород моноизотопен, что он нацело состоит из изотопа 16O. В масс-спектрометрических измерениях эталоном массы служил атом кислорода, именно с ним сравнивали массу других атомов, в том числе легчайшего - водородного. И вот что интересно: примеси тяжелых изотопов и у кислорода, и у водорода очень малы. Данные физиков и химиков практически совпали, потому что первые определяли массу протия (легкого водорода-1), сравнивая ее с массой легкого же кислорода-16. Химики же природную смесь изотопов водорода сравнивали с природной смесью изотопов кислорода. Легкий изотоп "взвешивали" легкой гирей, а более тяжелую изотопную смесь - тяжелой. Вот и получилось, что взвешивания с разными эталонами массы совпали с точностью до пятого знака!
Ошибка была обнаружена в 1931 году. Американцы Р. Берджи и Д. Менцель, всюду опираясь на один эталон - 16О сравнили значения масс водорода, полученные на масс-спектрометре и в химических определениях. Получилось 1,00778 для изотопа 1Н и 1,00799 для природного водорода. Разница - большая, чем считали прежде. Берджи и Менцель предположили, что в природном водороде содержится и незначительное количество изотопа с массовым числом 2. Вычислить его долю, которая бы устраняла противоречие между цифрами, полученными в результате физических и химических исследований, не составило труда. Эта доля первоначально была определена как 1/4500. По нынешним данным она меньше - 1/6800.
СДВИГ ЧЕТЫРЕХ ЛИНИЙ
В статье Берджи и Менцеля указывалось, что найти тяжелый водород в природе можно, видимо, не только ставшим уже традиционным масс-спектрометрическим методом, но и с помощью оптических спектров. Американский физик Гарольд Юри решил изучить возможные изменения в атомных спектрах водорода, вызываемые присутствием тяжелых изотопов.
Атомные спектры водорода получаются, если перед щелью спектроскопа поставить колбу с водородом, светящимся под действием электрического разряда. В видимой области обнаруживаются спектральные линии с длинами волн 656,3; 486,1; 434,0; 410,2 нанометра.
Еще в 1885 г. И. Бальмер из Швейцарии подобрал формулу, по которой можно рассчитать длины волн характерных для водородного атома линий. Формула отличалась необычайной точностью и очень помогла Нильсу Бору в создании квантовой теории атома. В современном виде формула Бальмера записывается так:
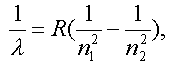
где n1 и n2 - значения главного квантового числа для уровней энергий, между которыми происходит квантовый переход, - длина волны, a R - постоянная Ридберга.
Величина R зависит от массы электрона и в гораздо меньшей степени от массы атомного ядра. Линии бальмеровской серии дейтерия по отношению к линиям легкого водорода должны быть сдвинуты на 1-2 ангстрема. Такой сдвиг уверенно фиксируется приборами. На него и рассчитывал Гарольд Юри, готовя свой эксперимент.
Первые попытки обнаружить смещенную серию Бальмера в спектре природной воды оказались неубедительными - не хватило чувствительности спектрографа. Получить более четкие линии можно было бы после обогащения водорода дейтерием, но как это сделать? Юри решил использовать фракционную перегонку жидкого водорода. Упругость паров Н2 в этом процессе должна быть выше, чем у молекул состава HD или D2. Поэтому при испарении жидкого водорода тяжелые молекулы должны переходить в газовую фазу несколько медленнее, и можно надеяться, что жидкий остаток будет обогащаться дейтерием.
Чтобы получить пробу водорода, обогащенного дейтерием, пробу объемом всего в один кубический сантиметр, Юри испарял от 4 до 6 литров жидкого водорода. Опыты были повторены на этих обогащенных еще не открытым дейтерием пробах. На спектрограммах рядом с обычными бальмеровскими линиями четко проявились линии, слегка сдвинутые в сторону более коротких волн. Увеличив плотность тока в разрядной трубке и применив для фотографирования спектров более чувствительные фотопластинки, спектры дейтерия сумели позже обнаружить и в естественном водороде. Так по спектральным линиям, подобно рубидию, цезию, индию и таллию, был открыт дейтерий.
ОТКУДА ДЕЙТЕРИЙ?
Чтобы познакомиться с ним поближе, пришлось создавать эффективные способы разделения изотопов водорода. Началось с того, что Э. В. Уошборн и Г. Юри, исследовав старую воду из ванны промышленного электролизера, убедились, что в ней дейтерия больше, чем в обычной воде. Объяснение было найдено быстро: в процессе разложения воды на кислород и водород преимущественно выделяется легкий изотоп протий, дейтерий же соединен с кислородом более прочно. Так уже на первом этапе познания этого необычного изотопа было замечено одно из его важных химических отличий от водорода обычного.
Электролитический метод разделения изотопов водорода стал основным в годы, предшествовавшие второй мировой войне.
Сейчас с помощью этого метода получают воду, содержащую 99,9% дейтерия. Тяжелую воду D2O получают путем постепенного или, правильнее, поступенного разделения протиевой и дейтериевой воды. Ступеней обычно 5-7.
Еще в 1934 г. завод норвежской фирмы "Норск Гидро" ежедневно выпускал около десяти литров тяжелой воды. Спустя девять лет в оккупированной фашистами Норвегии это производство, а с ним и 1300 кг тяжелой воды были уничтожены героями Сопротивления. Бомбардировщики союзников лишь завершили дело. К тому времени уже стала известна роль тяжелой воды в создании атомного оружия. Дейтрон в отличие от протона слабо поглощает нейтроны, но хорошо замедляет их. Тяжелая вода - идеальный замедлитель нейтронов в атомных реакторах...
В военное время важно было разработать дешевые, не слишком энергоемкие способы производства дейтерия. Наиболее рациональными оказались методы получения тяжелой воды, основанные на реакциях изотопного обмена. Так, при равновесии между водой и газообразным водородом в жидкости почти втрое больше дейтерия, чем в газовой фазе. Правда, равновесие устанавливается слишком медленно. В производстве больших количеств дейтерия проблему решает специальный катализатор. Через заполненную им башню движутся два встречных потока: вверх - смесь водорода и водяного пара, вниз - воды. Газовая фаза, пар, обогащается дейтерием, затем конденсируется и уносится потоком воды. Из основания башни вытекает вода, обогащенная дейтерием. Каскад из нескольких таких башен дает достаточно концентрированную тяжелую воду.
Эффективна для получения дейтерия и реакция изотопного обмена между водой и сернистым водородом.
РАЗНИЦА В СВОЙСТВАХ
Открытие дейтерия изменило представления о полной идентичности химических свойств у изотопов одного элемента. Не будь этих различий, изотопы нельзя было бы разделять химическими методами. Скорости некоторых реакций, в которых участвуют соединения протия и дейтерия, различаются в 5-10 раз. На тяжелую воду - окись дейтерия заметно реагируют живые организмы. Еще в начале тридцатых годов была надежно установлена токсичность концентрированной (80-100% D2C) тяжелой воды, хотя, как рассказывают, Г. Юри в свое время выпил полный стакан концентрированной тяжелой воды, и на нем это никак не отразилось. По-видимому, разовая доза окиси дейтерия сравнительно безвредна. Различия в физических свойствах протия и дейтерия, обычной и тяжелой воды также довольно значительны. Температура кипения протия 20,39°К, дейтерия - 23,57°К, трития (о нем речь впереди) - 24,90°К. Тяжелая вода замерзает при 3,82°С, кипит - при 101,42°С.
"Heavy water is the best moderator" - так, почти стихами рекламировали тяжелую воду американские фирмы. Действительно, она оказалась лучшим "модератором" - дословно "посредником", замедлителем, усреднителем, если угодно...
Прекрасные замедляющие свойства тяжелой воды полностью определяются ядерными характеристиками дейтерия. Медленные нейтроны почти не поглощаются дейтронами, а быстрые в среднем на одном столкновении с ним теряют 52% своей кинетической энергии. Всего 25 столкновений с атомами дейтерия, и нейтрон, освободившийся при делении тяжелого ядра (ядра урана, например), становится тепловым. Для графита аналогичное число столкновений равно 114. В обычной воде нужное замедление достигается уже после 18 столкновений, но протий в 700 раз сильнее дейтерия поглощает тепловые нейтроны.
Чтобы ядерная реакция пошла на обычной, скажем, колодезной воде, нужен уран, сильно обогащенный ураном-235.
ДЕЙТЕРИЙ В ЯДЕРНЫХ ИССЛЕДОВАНИЯХ
Почти в любом учебнике ядерной физики вы найдете отдельную главу, посвященную дейтрону, потому что это ядро - единственное связанное состояние двух нуклонов. Это идеальный объект для изучения ядерной материи, для познания сил, действующих в ядре. Нейтронно-протонная гантель - квантовомеханическая система всего двух тел. Такая система в отличие от систем со многими частицами хорошо поддается расчету и служит единственным в своем роде субмикроскопическим полигоном для сравнения теоретических представлений и экспериментально обнаруженных фактов.
Изучение дейтрона оказалось исключительно плодотворным. Из его ядерных характеристик извлечены фундаментальные выводы о характере ядерных сил - о малом радиусе их действия, о зависимости характера взаимодействия частиц от взаимной ориентации их спинов.
Дейтрон - слабо связанная система. Если дейтроновую мишень облучать достаточно энергичными гамма-квантами, гантель под действием кванта разваливается на протон и нейтрон. Именно этим путем впервые была измерена связь протона с нейтроном в дейтерии. Она оказалась небольшой - всего 2,23 МэВ. В более сложных ядрах частицы скреплены примерно в семь раз крепче.
Благодаря слабой связи нуклонов, расщепляя дейтерий, получали (и получают) моноэнергетические потоки нейтронов с энергиями от 0,1 до 1 МэВ. Если же бомбардировать дейтронами, ускоренными в электростатической трубке, мишень из соединений того же самого дейтерия, летят нейтроны с энергией от 2 до 6 МэВ. И те и другие - важный инструмент нейтронной физики. Именно этими нейтронами пользовались во многих исследованиях первого этапа атомной энергетики. Именно с их помощью измерены многие важные ядерные константы.
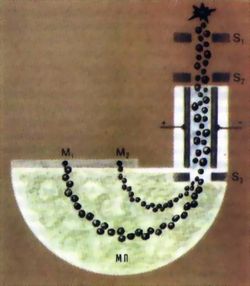
Схема масс-спектрографа. Из источника через щели S1 и S2 ионы анализируемого элемента попадают в электромагнитное поле. Его характеристики подобраны так, что из щели S3 ионы вылетают с одинаковой скоростью. Эти ионы попадают в магнитное поле (МП). Группы частиц с одинаковой массой М, будут здесь двигаться по одним и тем же траекториям и дадут линию на фотопластинке. Радиус траектории пропорционален массе иона, поэтому она легко определяется по положению линий на пластинке
Из-за малой связи между нуклонами дейтрон в некоторых процессах ведет себя как относительно свободная комбинация нейтрона и протона. Приближаясь к ядру-мишени, протон отталкивается электрическими силами от ядра. На нейтрон же электрическое поле не действует. В результате на малых расстояниях от мишени дейтрон раскалывается на протон и нейтрон. Протон отлетает от бомбардируемого ядра, а нейтрон вливается в него, подхваченный ядерными силами. Пример такой реакции - образование изотопа водорода с массовым числом 3 - трития, обычно обозначаемого символом Т:
![]()
В этой реакции тритий был открыт Э. Резерфордом, М. Олифантом и П. Хартеком в 1934 г. при бомбардировке соединений, содержащих дейтерий, ускоренными дейтронами. Ученым удалось зарегистрировать появление частиц с зарядом, равным единице, и малым пробегом в воздухе. Из этих данных следовало, что масса частицы равна примерно трем. В дальнейшем по энергиям продуктов реакций и атомным массам известных изотопов водорода атомную массу трития удалось вычислить достаточно точно.

Взвешивание разных атомов разными "гирями"
ПОДРОБНЕЕ О ТРИТИИ
Предпринятые на первых порах попытки обнаружить тритий в природе оказались безуспешными. Только после изучения его свойств (а тритий в отличие от протия и дейтерия радиоактивен, он испускает мягкие бета-лучи с периодом полураспада 12,262 года и превращается в гелий-3) по характерным бета-частицам удалось зарегистрировать присутствие трития в природной воде, обогащенной этим изотопом в 10000 раз. В обычной воде один атом трития приходится на 1018 атомов протия. Это значит, что во всех земных водоемах, включая Мировой океан, радиоактивного водорода не больше 100 кг.
Земной тритий - космического происхождения. Он образуется в атмосфере двумя путями: быстрые космические нейтроны расщепляют азот на два фрагмента - углерод-12 и тритий, а протоны высоких энергий и мезоны способны порождать тритий при взаимодействии с ядрами любых элементов, составляющих атмосферу.
Даже столь ничтожные количества природного трития оказались способны принести пользу науке. Так, по содержанию трития в дождевой воде удалось измерить время жизни облаков.
В ТЕРМОЯДЕРНОМ СИНТЕЗЕ
И все же главное назначение дейтерия и трития - служить ядерным топливом будущей большой энергетики.

Линии водорода 1Hальфа и 1Hбета и дейтерия 2Hальфа, 2Hбета. Расстояние между бальмеровскими линиями Hальфа, и Hбета = 1701 ангстрем, изотопическое смещение 1Н и 2D - порядка 1 ангстрем.
Иногда в популярных книгах приводят расчеты: сколько дейтерия в океанской воде и сколько миллиардов киловатт-часов скрыто в ядрах дейтерия. Получается очень много и киловатт-часов, и килокалорий. Впрочем, еще больше их получится, если, скажем, превратить в энергию вещество и эквивалентное количество антивещества. Правда, пока мы не знаем, как и откуда взять последнее.
О реакциях термоядерного синтеза известно гораздо больше. Рассматривают две основных реакции слияния ядер d + d > t + p + 4МэВ и t + d > альфа + n + + 17,6 МэВ (здесь t - тритон, ядро трития, как d - дейтрон, ядро дейтерия).
При прочих равных условиях чисто дейтериевая реакция d + d требует гораздо больших температур и дает значительно меньше энергии, чем реакция t + d. Во всяком случае, в обозримом будущем надежд на создание управляемого термоядерного реактора, в котором бы шла реакция d + d, - немного. Реальнее реакция t + d. Условия протекания такой реакции гораздо благоприятнее, но и здесь сложностей более чем достаточно (известные проблемы концентраций, температур, методов удержания плазмы). Менее известна наисложнейшая проблема воспроизводства трития.
Тритий - очень дорогой изотоп, настолько дорогой, что стоимостью дейтерия по сравнению с ним можно пренебречь. А в значительных количествах тритий получают пока лишь в нейтронных потоках ядерных реакторов. Облучают природную смесь изотопов лития. Ядро легкого лития-6, захватив тепловой нейтрон, превращается в сильно возбужденное ядро лития-7, которое сразу же распадается на альфа-частицу и тритон:
![]()
Итак, не считая ядра лития, на атом Т расходуется нейтрон, а это уже серьезно. Если нейтрон пустить на производство 233U или плутония из "балластных" тория и урана-238, то получится топливо, дающее на каждый атом 160 МэВ энергии - почти в десять раз больше, чем при слиянии трития и дейтерия. Почему же тогда столько сил и энергии вкладывают в "термояд"? Да потому что в реакции t + d рождается новый нейтрон! И если эти новые нейтроны использовать на все 100% (или хотя бы чуть меньше), термоядерная реакция окажется экономичной.
Как это сделать? Замедлить быстрый нейтрон, полученный в реакции t + d, и направить его на ядро лития? Хорошо бы, но как показывает расчет, потери нейтронов в этом случае окажутся недопустимо большими.
Есть другой путь: минуя замедление, бомбардировать литий сразу. У быстрого нейтрона хватает энергии, чтобы кроме трития в реакции образовывался дополнительный нейтрон:
![]()
Таким путем тритий получается без потери нейтрона.... Остается преодолеть "технические трудности"...
ИМЯ СОБСТВЕННОЕ
"У каждого из нас своя фамилия...",- так начинаются известные стихи. Евг. Евтушенко.
Право на имя собственное есть у городов, железнодорожных станций, химических элементов. А вот у изотопов, как у разъездов и полустанков, обычно- лишь номера, обозначающие, правда, не расстояния, а атомные массы. Исключений из этого правила немного: имена собственные есть лишь у некоторых изотопов радиоактивных элементов, но в последнее время их все чаще обозначают, как полустанки. Не часто мы вспоминаем и о том, что обычный легкий водород-1 называется протием...
И лишь дейтерий и тритий - действительно именитые изотопы. По заслугам!
Водород: самое главное, самое интересное, самое неожиданное
КОНСТАНТЫ И СВОЙСТВА
Атомный номер - 1
Атомная масса - 1,00797
Органолептические свойства - при нормальных условиях газ без вкуса, запаха и цвета
Число известных (на 1.01.80) изотопов - 4
Массовые числа изотопов - 1, 2, 3, 4 (подчеркнуты природные изотопы, двумя чертами (1) - самый распространенный)
Молекула - Н2
Плотность при нормальных условиях - 0,0899 г/л
Температура кипения (ожижения) - минус 252,6°С
Температура плавления (твердения) - минус 259,1°С
Критическая температура - минус 240°С
Степени окисления - 1+, 1-
Электронное строение атома - 1s1
Энергия связи электрона с ядром - 13,595 эВ
ОТКРЫТИЕ ВОДОРОДА
Дата открытия водорода - 1766 г., когда английский естествоиспытатель Генри Кавендиш (1731-1810) собрал и исследовал "горючий воздух", выделяющийся при взаимодействии кислот с металлами. Кавендиш полагал, что он открыт и выделил в чистом виде флогистон.
Самостоятельным химическим элементом этот "горючий воздух" был признан после того, как Антуан Лоран Лавуазье в 1787 г. разложил воду на составляющие, а затем вновь синтезировал ее. Лавуазье же предложил назвать новый элемент гидрогеном, т. е. "рождающим воду", отсюда и русское название элемента № 1 - водород.
"НА ЗЕМЛЕ, В НЕБЕСАХ И НА МОРЕ..."
Распространенность водорода... Одним словом, одной цифрой о ней не скажешь. Во Вселенной водород, безусловно, самый распространенный элемент. В виде плазмы он составляет около половины массы Солнца и большинства звезд. Из водорода в основном состоят газы межзвездной среды и газовые туманности. Корпускулярное излучение Солнца и космические лучи в значительной мере состоят из протонов - ядер атомов водорода.
Содержание водорода в земной коре - 1 % по массе и 16% по числу атомов. Практически весь земной водород связан в соединения. Очень редко в минимальных количествах встречается свободный водород в вулканических и других природных газах. Крайне незначительно его содержание и в атмосфере Земли (0,0001 % по числу атомов, если не считать, конечно, водорода водяных паров).
В составе воды - самого распространенного на Земле вещества - водорода 11,19% по массе, а сколько по числу атомов, вы сами знаете.
КОРОТКО О СВОЙСТВАХ
Водород - самое легкое из всех веществ. Он в 14,4 раза легче воздуха. Чрезвычайно легок и жидкий водород - 0,0708 г/см3 при минус 253°С.
Водород обладает наибольшей среди всех газов теплопроводностью.
В воде он растворяется плохо - 0,0182 мл/г при нормальных условиях. Но зато очень хорошо - во многих металлах, лучше всего - в палладии (850 объемных частей водорода на одну часть металла). Чрезвычайно подвижный водород диффундирует сквозь многие металлы и сплавы - отсюда сложности его хранения. Иногда диффузия сопровождается химическим взаимодействием водорода с теми или иными компонентами сплава. Отсюда - широко известная инженерам водородная хрупкость. В стали под действием водорода происходит декарбонизация, обеднение ее углеродом.
В соединениях водород обычно проявляет степень окисления (валентность) + 1, т. е. ведет себя подобно щелочным металлам. Однако в гидридах - соединениях водорода с металлами - ион водорода отрицательно одновалентен (1-). Этим объясняется двойственное положение водорода в таблице элементов: его помещают одновременно ив I и в V II группу. Водород обладает ярко выраженными восстановительными свойствами, но при обычных условиях химическая активность молекулярного водорода в отличие от щелочных металлов вполне умеренна. Без нагрева он реагирует лишь с фтором (даже в темноте) и с хлором (на свету). Реакция синтеза воды (водород плюс кислород) при нормальных условиях идет очень медленно. Нагревание, естественно, ускоряет ее. При температуре выше 550°С она носит характер взрыва.
Вообще, как правило, с неметаллами водород взаимодействует активнее, чем с металлами. Из последних предпочитает химически активные - щелочные и щелочноземельные. В этих реакциях образуются гидриды.
О ГИДРИДАХ
Далеко не все соединения водорода с металлами построены так просто, как гидриды щелочных и щелочноземельных металлов: валентность водорода -1, металла - +1 или + 2 состав соединений соответственно МеН или МеН2. Эти гидриды - их называют солеобразными - образованы классическими ионными связями. Они хорошо изучены и довольно широко применяются в практике. Гидрид кальция, например, СаН2 используют в порошковой металлургии, с его помощью получают титан, тантал, ниобий, цирконий.
Чтобы удалить с металла окисную пленку, иногда применяют слабый, 1,5-2%-ный раствор гидрида натрия в едком натре. Этот же гидрид (и гидрид лития) используют, получая бороводороды.
Но вот строение бороводородов - тоже гидридов! - в рамки классических представлений о валентности не укладывается. Какова валентность бора в таких соединениях: В2Н6, В4Н10, В5Н9 и т. д.? Эти гидриды, так же как гидриды гелия и элементов IV, V, VI и VII групп (главных подгрупп), называют летучими гидридами. Химическая связь в них - ковалентная или полярная. Между прочим, все многообразие углеводородов - лишь частный случай летучих гидридов.
А еще есть гидриды металлические (металлообразные). Как правило, это твердые растворы водорода в металле. По свойствам и характеру химической связи эти гидриды сходны с металлами. К гидридам этой группы относится, в частности, двойной гидрид переменного состава TiFeXx его применяют в экспериментальных автомобильных двигателях, для которых горючим служит выделенный из гидрида водород.
ВОДОРОДНАЯ СВЯЗЬ
Так называется один из самых своеобразных видов химической связи, возникающей во многих водородсодержащих молекулах, начиная с воды и кончая белками и ферментами. В образовании этих связей участвуют атомы водорода, уже ковалентно связанные с другими атомами. Водородные связи слабые, примерно в 20 раз слабее обычных, но значение их велико. Ими, в частности, объясняются во многом аномальные свойства обыкновенной воды (например, намного большие, чем "положено", температуры кипения). Причиной тому - многочисленные межмолекулярные водородные связи. А возникают они оттого, что ион водорода - положительно заряженный протон, хорошо притягивается к отрицательно заряженным электронным оболочкам других атомов, не испытывая при этом (заряд-то минимальный) сильного отталкивания ядер.
рН - ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
Так называется традиционная численная характеристика кислотности (или щелочности) раствора. Величина рН - десятичный логарифм активности ионов водорода Н+ (в грамм-ионах на литр), взятый со знаком минус. Для нейтральных водных растворов рН равен 7,0, для щелочных - от 7 до 14, для кислых - от 0 до 7. Но для чистой воды рН=7 лишь при комнатной температуре. С повышением температуры диссоциация водных молекул увеличивается, и при 100°С величина рН нейтрального водного раствора чистой воды - около 6, а при температуре ниже 20°С - выше 7.
ВОДОРОД В ФИЗИКЕ
Заслуги элемента № 1 перед этой наукой, особенно ядерной физикой, очень велики. Постулаты Бора, объяснившие строение атома на основе представлений квантовой механики, были быстро признаны прежде всего потому, что спектр водорода, вычисленный Бором по его теории, совпал с реально наблюдаемым.
Важным инструментом познания микромира стали водородные пузырьковые камеры.
Протон - ядро водорода - легчайший из атомных "снарядов", используемых при ядерном синтезе.
ОРТО И ПАРА
На заре квантовой механики В. Гейзенберг и Ф. Гунд предсказали, что молекула водорода Н2 должна существовать в двух состояниях, которые по аналогии с органическими соединениями назвали орто- и параводородом. В молекулах параводорода ядерные спины антипараллельны, в ортоводороде - параллельны. Это предсказание сбылось. Экспериментально доказан факт существования двух разновидностей водородных молекул, свойства которых (температуры плавления, теплоемкости, теплопроводности и др.) незначительно отличаются. При нормальной температуре примерно 75% водородных молекул находятся в ортоположении. С уменьшением температуры растет доля параводорода. А на грани перехода в жидкое состояние практически все водородные молекулы - это параводород.
ВОДОРОД В ХИМИИ
В химической промышленности большая часть водорода используется для синтеза аммиака. Из водорода и СО получают метанол и другие спирты, а из них, в свою очередь, широчайшую гамму разнообразных органических продуктов.
Гидрогенизация - обогащение водородом природных горючих ископаемых (углей, сланцев) и продуктов их переработки (каменноугольной смолы, мазута) - позволяет получить ценные жидкие продукты - топлива, масла и т. д.
Гидроочистка - облагораживание с помощью того же водорода моторных топлив нефтяного происхождения, в частности авиационного керосина.
Кроме того, водород в химии, естественно, используется и как восстановитель.
То еще читать в "Химии и Жизни" о водороде и его соединениях
В. Е. Жвирблис. Водород.- 1969, № 9, стр. 30-38.
В. 3яблов. Нечто плюс водород.- 1979, № 5, стр. 20- 24.
В. 3яблов. Слабость и могущество водородной связи.- 1979, № 2, стр. 14-18.
И. В. Петрянов. Самое необыкновенное вещество. (Вода) - 1965, № 3, стр. 2- 14.
М. Б. Черненко. Водород: может быть, элемент № 1 энергетики будущего.- 1977, № 9, стр. 19-21.
В. А. Цукерман. Автомобиль и водород.- 1977, № 9, стр. 21-26.
Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки
Помоги сайту! Брось денежку в смс-копилку!