 | Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки |
Архив статей > Химия > Чем славен углерод, или полимеры в природе
Чем славен углерод, или полимеры в природе
Я. М. Слободин
Химия и Жизнь №10, 1980 г., с. 8-12
Углерод - основа жизни на Земле. Характерная особенность этого элемента заключается в его способности образовывать олигомеры и полимерные соединения, разнообразие которых практически не знает границ. Но вот вопрос: уникален ли вообще углерод как основа жизни или же просто на Земле сложились такие конкретные физико-химические условия, что живая природа отдала предпочтение именно элементу № 12? Писатели-фантасты не раз обыгрывали ситуацию, когда космические путешественники попадали на планету, населенную живыми существами, в чьих организмах роль углерода выполняет кремний или какой-либо другой элемент. А что говорит по этому поводу наука?
Если рассмотреть все существующие в природе элементы, то прежде всего бросается в глаза, что при обычных земных условиях в атомарном (так сказать, мономерном) состоянии способны существовать, лишь немногие элементы. Это, конечно, благородные газы (Не, Ne, Ar, Kr, Xe, Rn); мономерны также пары ртути. И все. Остальные элементы существуют в природе в виде молекул различной степени сложности, для разложения которых на отдельные атомы необходимы температуры, измеряемые сотнями и тысячами градусов: так, для азота температура, при которой молекулы N2 заметно диссоциируют, распадаясь на отдельные атомы, превышает 3000°С.
Иначе говоря, в природе подавляющее большинство элементов существует либо в виде двухатомных молекул (димеров), либо в форме полимеров, насчитывающих в частице многие сотни и тысячи атомов.
Например, димерны молекулы Н2, N2, F2, Cl2, Na2 (при температуре кипения). Кислород образует молекулы О2, О3 и возможно О4, то есть представляет собой димер, тример или даже тетрамер. Фосфор тетрамерен - Р4 и полимерен - Рn. Сера существует в форме октамера S8 и полимера Sn. Углерод образует молекулы С2 лишь в атмосфере Солнца, а в земных условиях всегда полимерен и существует в форме алмаза, графита или карбина. Примеров подобного рода можно привести сколько угодно.
Полимерия характерна не только для атомов; многие молекулы простых химических соединений существуют в полимерной форме. Хорошо известна склонность таких молекул, как NO и NO2, легко димеризоваться с образованием (NO)2, и (NO2)2 соответственно. Полимерен фтористый водород. Особенно необходимо подчеркнуть способность воды давать ассоциаты до (Н2О)6 включительно, в результате чего почти все свойства воды оказываются аномальными, выделяющими ее среди всех других жидкостей.
Димерны оксиды фосфора: его трех-окись и пятиокись имеют состав Р4О6 и Р4О10 соответственно. Полимерна трехокись серы (SO3)n, где степень полимеризации доходит до 1000.
Полимерны все ионные кристаллы. По сути дела, степень полимеризации ионного монокристалла ничем не ограничена, и такой кристалл можно считать одной огромной молекулой. То же можно сказать и 6 металлических кристаллах.
В органических природных полимерах, построенных на основе ковалентных связей, степень полимеризации может выражаться шести- и даже девятизначными цифрами. Заметим, что природные неорганические соединения тоже представляют собой высокомолекулярные полимеры.
Таким образом, можно смело сказать, что полимерия скорее не исключение, а правило - она характерна как для атомного, так и для молекулярного уровня организации материи.
Рассмотрим теперь некоторые причины возникновения полимерии.
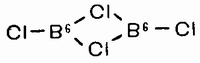
Прежде всего укажем на так называемое правило кратной связи. Суть его можно сформулировать так: способность двух атомов соединяться кратной (двойной или тройной) связью характерна лишь для небольшого числа элементов, относящихся ко второму периоду системы элементов. Из восьми элементов этого периода литий и фтор одновалентны и, естественно, не могут предоставить двух электронов, необходимых для образования двойной связи. Бериллий и бор характеризуются дефицитом электронов, и потому, хотя образуемые ими бинарные соединения димерны или полимерны, они не могут содержать кратных связей.
Так, хлорид бериллия BeCl2 димерен, он имеет структуру с трехцентровой связью:
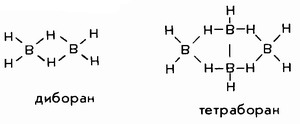
Еще сложнее структура соединений бора, способного давать ряд олигомерных гидридов:
В молекуле кислорода О2 можно было бы ожидать наличия двойной связи О = О; однако в действительности такой связи тут нет. Структура этой молекулы может быть изображена так:
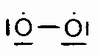
То есть каждый атом кислорода вместо октета содержит только по семи электронов. Эта особенность кислорода исключительно важна, так как придает ему в известной мере свойства свободного радикала и позволяет понять его исключительно высокую химическую активность и роль в существовании и поддержании жизни на Земле.
Еще меньше элементов способно участвовать в образовании тройной связи. Естественно, это должны быть такие элементы, которые имеют не менее трех одиночных электронов; таким образом, только два элемента второго периода, углерод и азот, могут участвовать в образовании соединений с тройной связью.
Для элементов третьего периода образование кратных связей не характерно (они образуются лишь как исключение). Здесь обычно за счет неподеленных электронных пар атомов происходит образование полимеров, которые могут быть как низкомолекулярными, так и высокомолекулярными, но, как правило, содержат лишь ординарные связи.
Так, сера в обычных условиях представляет собой циклический полимер - октамер:
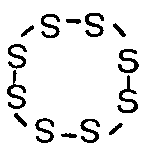
В определенных условиях можно получить высокомолекулярную пластическую серу, которая также не содержит двойных связей; эта форма малоустойчива и при обычной температуре за несколько дней самопроизвольно переходит в изображенную выше циклическую форму.
Аналог азота - фосфор, как известно, существует в трех модификациях, из которых наиболее низкой молекулярной массой обладает белый фосфор, состав которого Р4. Молекула Р4 характеризуется объемной, тетраэдрической структурой и не содержит кратных связей:
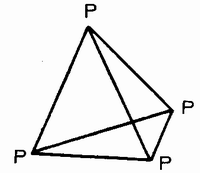
Только при 1200° эта модификация распадается на 50%, давая молекулы Р2, а отдельные атомы Р возникают лишь выше 2000°.
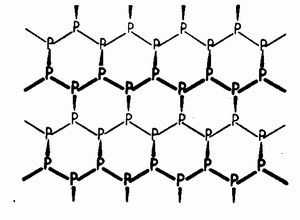
Другие модификации фосфора (фиолетовый и черный фосфор) структурно настолько сложны, что перевести их в парообразное состояние вообще невозможно. Эти высокомолекулярные модификации представляют собой пространственные сетки, составленные из атомов фосфора, связанных между собой только ординарными связями:
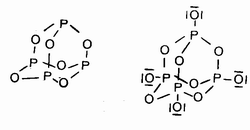
При взаимодействии фосфора с кислородом происходит внедрение атомов кислорода по связям Р-Р, в результате чего получаются структуры, отвечающие составу Р4О6 и Р4О10, которые можно назвать "алмазоподобными". Как видно из рисунка, в этих структурах кратные связи тоже отсутствуют:
Не будем касаться последующих элементов пятой группы - для них полностью действительно все сказанное выше.
Сложнее обстоит дело у элементов четвертой группы. В полимерной кристаллической решетке элементарного углерода могут содержаться двойные связи. Так, графит имеет слоистую структуру, причем каждый слой построен из плоских шестичленных циклов, содержащих двойные связи (рис. 1, А). Длины связей между слоями больше, чем внутри слоев, что вызывает делокализацию электронов и появление у графита частичных металлических свойств.
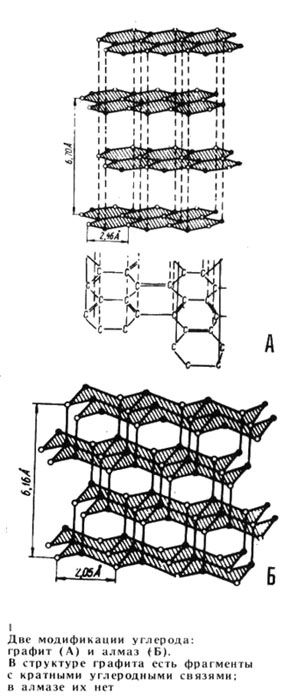
В отличие от графита, другая аллотропическая модификация углерода, алмаз, не содержит кратных связей: алмаз характеризуется совершенно правильной кристаллической структурой с одинаковыми расстояниями между всеми соседними углеродными атомами (рис. 1, Б). С этой структурой связано такое свойство алмаза, как исключительно высокая твердость.
Большой интерес представляет искусственно полученный линейный полимер углерода - карбин, содержащий двойные или тройные связи:
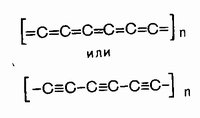
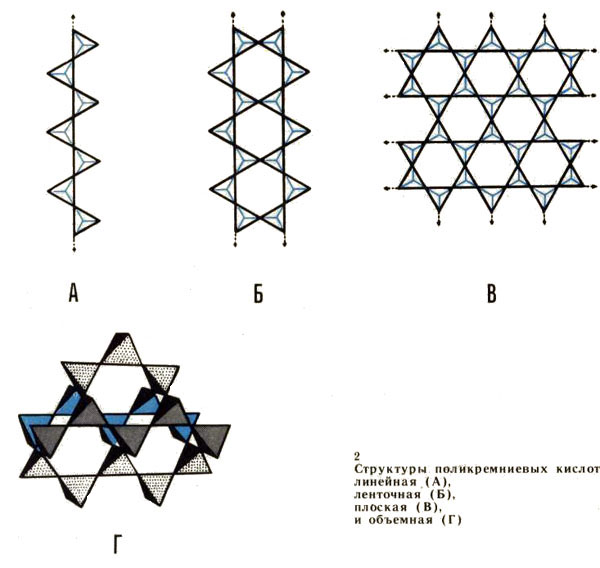
Однако для кремния, который представляет собой аналог углерода по четвертой группе, но находится в третьем Периоде, начинает действовать правило кратной связи, и потому кремний в своих природных соединениях всегда полимерен, но природные силикаты образованы поликремниевыми кислотами, которые не содержат двойных связей. Они построены либо в виде цепей (H2SiO3)n, либо в виде сдвоенных цепей или лент (H6Si4O11)n, либо в виде плоских решеток (H2Si2O5)n, либо, наконец, в виде пространственных решеток (SiO2)n(рис. 2).
Так подтверждается общая закономерность: кратные связи способны образовать преимущественно элементы второго периода, точнее, углерод, азот и кислород. В остальных периодах мономерные молекулы за счет неподеленных электронных пар превращаются в полимерные формы, не содержащие кратных связей.
А теперь вновь вернемся к элементам пятой группы. Азот, находящийся во втором периоде системы, способен давать соединения, содержащие кратные связи. При образовании иона нитрата NO3- атом азота, связываясь с тремя атомами кислорода, оказывается в окружении шестерки, секстета электронов. Такая система оказывается недостаточно устойчивой, что приводит к перегруппировке электронов, в результате которой кислород поставляет пару электронов, а азот ее принимает. Атом азота оказывается в окружении устойчивого октета, и ион нитрата оказывается стабильным, но между азотом и кислородом возникает двойная связь:
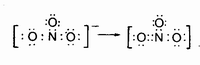
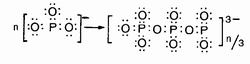
Иначе ведет себя ион метафосфата РО3-. Стабилизация этого иона также происходит за счет неподеленной электронной пары кислорода, но только эта пара передается соседней частице, что приводит к образованию полимерного иона, не содержащего кратных связей:
То же самое происходит в случаях молекулы SO3, иона [SiO3]2- и многих других - различие заключается лишь в степени полимеризации. Можно добавить, что, когда степень полимеризации не превышает шести, образуются, как правило, циклические формы, тогда как при больших степенях полимеризации получаются длинные цепи, а зачастую двух- и трехмерные пространственные структуры.
Углерод и его соединения занимают в природе (а не только на Земле) особое положение, потому что он находится в четвертой группе второго периода системы элементов и оказывается единственным элементом, у которого валентность и координационное число совпадают. В результате углерод обладает способностью давать соединения с практически любым числом атомов в цепи, в которой может быть любое число кратных связей и в любом сочетании. Отсюда безграничное многообразие органических соединений - как природных, так и синтетических.
Только высокомолекулярные соединения углерода могут служить носителями жизни в любом уголке Вселенной, ибо Периодический закон потому и закон, что действует повсеместно.
И если вновь задаться вопросом, возможна ли безуглеродная жизнь, то ответ должен быть определенно отрицательным.
Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки
Помоги сайту! Брось денежку в смс-копилку!