 | Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки |
Архив статей > Химия > Бор
Бор
Инженер В. В. Станицын
Химия и Жизнь №7, 1969 г., с. 24-31
"Нужно очень много знать, чтобы понять, как мало мы знаем". Вся история элемента № 5 - бора может служить подтверждением этого не слишком нового тезиса.
Было время, когда казалось, что об этом элементе известно все, что необходимо, хотя в действительности знали очень немного. А большего не требовалось: для промышленности бор не представлял интереса...
Лишь в последние десятилетия бор стал элементом первостепенной важности: и сам элемент № 5, и многие его соединения понадобились атомной и ракетной технике, металлургии, металлообработке, химической промышленности и многим другим отраслям. Сейчас бором и его соединениями занимаются в десятках научных лабораторий (и вряд ли этот интерес временный), а он задает одну загадку за другой.
БУРА И БУРОТВОР
С одним из соединений бора человечество знакомо более тысячи лет. Это бура - натриевая соль тетраборной кислоты Nа2В4О7·10Н2О. Известно, что еще в восьмисотых годах нашей эры (не 1800-х, а просто 800-х) это белое кристаллическое вещество применяли в качестве плавня. Бурой пользовались алхимики; как и сама алхимия, бура пришла в Европу с востока, от арабов. Известно, что много веков назад словом "борак" арабы обозначали многие соли и другие кристаллические вещества белого цвета. По мере того, как прояснялась химическая природа веществ, понятие "борак" становилось все уже, и в конце концов его стали употреблять применительно только к одному веществу - буре. От арабского "борак" происходит латинское название буры - borах.
Несколько меньше "трудовой стаж" другого распространенного природного соединения бора - борной кислоты. В природе ее обнаружили в 1777 году, а получать из буры научились на 75 лет раньше. Самые старые соединения элемента № 5 и сейчас используются довольно широко: в медицине, в производстве эмалей, как сырье для получения других соединений бора. Конечно, не бура и не Н3ВО3 определяют нынешний интерес науки и техники к бору, но эти вещества заслуживают почтительного отношения за свою многолетнюю службу человечеству. И открывали бор именно как неизвестный компонент этих известных веществ. И бором-то его назвали в честь буры. Интересно, что у нас в начале прошлого века (1810-1815 годы) этот элемент называли на русский манер бурием и буротвором. Лишь в 1815 году известный химик В. М. Севергин ввел в русскую научную литературу нынешнее имя элемента № 5.

ИСТОРИЯ ОТКРЫТИЙ И ОШИБОК
Бор открыт в 1808 году. Два известных французских ученых Жозеф Гей-Люссак и Луи Тенар "отняли" воду у борной кислоты и на полученный окисел подействовали металлическим калием. Новое вещество совершенно не походило на исходные продукты, химизм процесса казался очевидным: кислота -(прокаливание)-> ангидрид -(восстановление)-> элемент
И с полным на то основанием Гей-Люссак и Тенар объявили об открытии нового элемента.
Спустя несколько месяцев бор открыли вторично. Английский химик Гемфри Дэви получил его при электролизе расплавленного борного ангидрида.
На этом, казалось бы, можно закончить рассказ об истории элемента № 5, но одно обстоятельство не позволяет сделать это - сопоставление характеристик элементарного бора, полученных его первооткрывателями и современной наукой: величины настолько разные, что кажется, будто речь идет о разных, и притом не очень похожих, веществах...
В рассуждениях великих химиков прошлого века все абсолютно правильно, и тем не менее открытое ими вещество никак не назовешь элементарным бором. Из-за большого сродства бора ко многим элементам, и прежде всего к кислороду, продукт, полученный Гей-Люссаком и Тенаром, не мог содержать больше 60-70% бора. То же самое и у Дэви. Это доказал Анри Муассан - выдающийся французский химик второй половины XIX века. Он же в 1892 году предложил магниетермический способ получения бора по реакции:
В2О3 + 3Mg = 3MgО + 2В + 127 ккал.
Коричневый порошок, остававшийся после удаления окиси магния, Муассан считал элементарным бором. Но оказалось, что и этот бор - далеко не элементарный: бора в нем не больше 90%. Немецкий ученый-металлург В. Кролль усовершенствовал способ Муассана, но и он не смог поднять чистоту конечного продукта выше 93-94%.
...Помимо всего прочего, бор знаменит еще и тем, что портил нервы многим выдающимся химикам. В 1858 году Ф. Велер и А. Сент-Клер Девиль установили, что этот элемент существует в двух модификациях: кристаллической - алмазоподобной и аморфной - похожей на графит. Это положение быстро стало общепризнанным, вошло в монографии и учебники.
Но в 1876 году немецкий химик В. Гампе опубликовал статью, в которой утверждал, будто алмазоподобный бор, полученный тем же способом, что у Велера и Сент-Клер Девиля,- это не элементарный бор, а борид алюминия состава АlВ12. Через семь лет та же участь постигла графитоподобный бор. Его формулу - В48С2Аl - установил француз К. Жоли.
Результаты работ Гампе и Жоли, естественно, вызвали сомнения коллег. И дело здесь не только в авторитете Велера и Сент-Клер Девиля - выдающихся ученых и отличных экспериментаторов. Формулы, полученные Гампе и Жоли, "не лезли ни в какие ворота" (если воротами считать классические теории валентности и химической связи).
Тогда еще не знали, что атомы бора способны к образованию не только ионных, но и ковалентных связей; что они могут соединяться между собой в цепочки, каркасы, сетки; что при образовании боридов (соединений бора с металлами) происходит как бы "наложение" нескольких типов химической связи. Зная о сродстве бора к кислороду, углероду, алюминию, в то время не догадывались, насколько велико это сродство.
В 1908 году американский исследователь Э. Вейнтрауб подтвердил странную формулу кристаллического бора - АlВ12. А на следующий год, восстановив хлорид бора водородом в электрической дуге, Вейнтрауб первым получил бор 99%-ной чистоты.
Тем не менее, и сегодня ответы на вопрос о свойствах и "внешности" бора достаточно противоречивы. Например, в "Краткой химической энциклопедии" (том I, стр. 451) говорится, что кристаллический бор - порошок серовато-черного цвета, а в другой энциклопедии химических знаний - трехтомных "Основах общей химии" Б. В. Некрасова описан бор "в виде темно-бурого порошка" и, кроме того, сказано, что "очень чистый бор бесцветен".
Где же истина? Как ни странно, и там и там. На свойства элемента влияют - и очень сильно - даже десятые и сотые доли процента примесей. "Элементарный" бор получают несколькими способами - крекингом бороводородов, восстановлением на раскаленной танталовой нити и в электрической дуге; но ни в одном случае не удается преодолеть высокое сродство бора к другим элементам, ни в одном случае не удается избежать "посторонних включений". До сих пор не получен бор чистотой больше трех девяток - 99,9%. Поэтому-то из одной авторитетной книги узнаем, что температура плавления элементарного бора - 2075° С, а из другой (не менее авторитетной) - 2300°. То же самое - с температурой кипения: в одном справочнике находим ее равной 2550° С, а в другом - 3860°. По-разному отвечают ученые и на вопрос, сколько же в действительности существует модификаций элементарного бора: одна, две. много...
Все это, однако, не помешало бору и многим его соединениям войти в число важнейших материалов современной техники. Это произошло благодаря уникальному сочетанию полезных свойств элемента №5.
АТОМ, ЯДРО, РЕАКТОР
Атом бора - "конструкция" довольно простая. В ядре пять протонов и пять или шесть нейтронов (изотопы бор-10 и бор-11 соответственно). Вокруг ядра вращаются пять электронов: два - на ближайшей к ядру оболочке, три - на наружной. Благодаря этим трем электронам бор и проявляет обычно валентность 3+.
К электронному строению мы еще вернемся. Сейчас же речь о ядре атома бора и об "атомной службе" этого элемента.
Природный бор состоит только из двух изотопов. На долю легкого бора-10 в природной смеси приходится около 19%, остальное - тяжелый бор-11. И эти цифры в разных изданиях несколько варьируются. Некоторые ученые считают, что отношение В11:В10 = 81:19 непостоянно и что в недрах Земли происходит частичное разделение и перераспределение изотопов бора. По мнению других, все отклонения в изотопном составе - от того, что определяют его разными приборами и методами; но и в работах ученых этой группы говорится, что бор, выделенный из морской воды, на 2%о тяжелее бора, полученного из минералов. Все сходятся на том, что бор мигрирует по планете, но какие процессы частично разделяют и перераспределяют изотопы бора - на этот вопрос никто не дал пока ответа.
Есть, правда, другое объяснение отклонений в изотопном составе бора, полученного из разных образцов. Суть его в том, что под действием протонов часть бора-10 превращается в бериллий-7, а тот, в свою очередь (после серии ядерных превращений),- в гелий-4.
Вопрос об изотопном составе элемента № 5 - далеко не праздный. По одной из самых важных для атомной техники характеристик - сечению захвата тепловых нейтронов - изотопы бора отличаются очень сильно.
Сечение захвата - это способность ядра захватывать замедленные (тепловые) нейтроны, служащие возбудителями и распространителями цепной ядерной реакции. С помощью веществ, имеющих большое сечение захвата, можно регулировать ход цепной реакции и, если нужно, гасить ее. Из таких веществ делают управляющие стержни атомных реакторов. Как конструкционные материалы "горячей зоны" такие вещества, конечно, не подходят. Наоборот, от элементов, имеющих большое сечение захвата, в том числе и от бора, конструкционные материалы атомной техники приходится тщательно очищать. Здесь нужны материалы с минимальным сечением, от которых нейтроны отскакивали бы как горох от стенки.
Большим сечением обладают изотопы, у которых в ядрах есть "вакансии" для нейтронов. Бор-10 - отличный тому пример: захватив нейтрон, его атом становится атомом стабильного бора-11. Напротив, бор-11, захватив нейтрон, превратился бы в бор-12, короткоживущий радиоактивный изотоп, который и при желании получить очень трудно.
По величине сечения захвата тепловых нейтронов легкий изотоп бора занимает одно из первых мест среди всех элементов и изотопов, а тяжелый - одно из самых по-следних. Это значит, что материалы на основе обоих изотопов элемента № 5 весьма интересны для реакторостроения (как, впрочем, и для других областей атомной техники). Интерес этот укрепляют отличные физико-механические свойства бора и многих его соединений: прочность, термостойкость, твердость. По твердости, например, кристаллический бор (AlB12) занимает второе место среди всех элементов, уступая лишь углероду в виде алмаза.
Разделять природный бор на изотопы и получать соединения бора с измененным изотопным составом умеют уже во многих странах. Разделяют, конечно, не элементарный бор, а одно из его соединений, чаще всего газообразный при нормальных условиях трехфтористый бор. В жидкость ВF3 превращается при температуре около минус 100° С. Установлено, что молекулы трехфтористого бора, в состав которых входит бор-11, немного подвижнее тех, в которых заключен бор-10. Из-за этого B11F3 испаряется из жидкого трехфтористого бора чуть-чуть легче и быстрее, чем В10F3. Этой минимальной разницей в свойствах и пользуются для разделения изотопов бора в ректификационных колоннах. Процесс этот сложный и долгий - все-таки разница в свойствах моноизотоппых фторидов бора очень невелика.
Конечно, регулирующие стержни делают не из фторида бора с измененным изотопным составом. Но превратить это соединение в элементарный бор или карбид бора В4С намного проще, нежели разделять изотопы. Это делается чисто химическими способами.
Способностью бора активно захватывать нейтроны пользуются и для защиты от нейтронного излучения. Широкое распространение получили борные счетчики нейтронов.
КОНКУРЕНТЫ АЛМАЗА
В предыдущей главе уже упоминался карбид бора В4С как один из материалов для изготовления регулирующих стержней. Но это вещество, впервые полученное еще Анри Муассаном, нужно не только атомникам. Уже много лет его применяют для обработки твердых сплавов, потому что по твердости карбид бора превосходит почти все прочие кристаллы и лишь немного уступает алмазу.
Этим черным блестящим кристаллам не страшен разогрев. С повышением температуры их свойства почти не меняются, а плавится карбид бора лишь при 2250°С. Более того, при температурах ниже 1000°С он обладает исключительной химической стойкостью: в этих условиях на него не действуют ни кислород, ни хлор. Это значит, что инструмент из карбида бора может работать при высоких температурах в окислительных средах.
Причины сочетания великолепных физико-механических и химических свойств этого вещества объясняются строением атома бора и кристаллической структурой карбида бора. Чтобы пояснить их, вернемся к элементарному строению элемента №5.
Напомним, что в атоме бора вокруг ядра вращаются пять электронов, из них три находятся на наружной оболочке. Эти три электрона способны образовывать ковалентные связи с электронами других атомов. А ковалентные связи - самые прочные из всех видов химической связи. Например, в полимерных молекулах ими соединены все атомы "скелета", поэтому так трудно разрушить связи в полимере, А поскольку в кристалле бора атомы связаны именно такой связью, то любой кристаллик элемента № 5 можно рассматривать как молекулу неорганического полимера.
Карбид бора - тоже полимер. Правильнее его формулу писать не В4С, а (В12С3)n. Элементарная ячейка таких кристаллов - ромбоэдрическая, ее каркас образуют 12 прочных, компактных (и ковалентно связанных) атомов бора. Внутри этого каркаса располагается линейная группа из трех связанных между собой атомов углерода. Ковалентные связи возникают также между "хозяевами" и "гостями". В результате получается настолько прочная конструкция, что ее очень трудно разрушить любыми воздействиями. Поэтому карбид бора и тверд, и прочен, и химически неуязвим, и термически стоек.
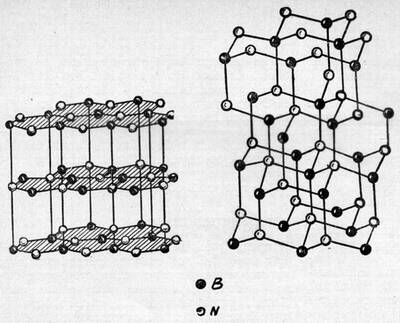
Кристаллы "Белого графита" и боразона. Сходство с графитом и алмазом очевидно.
Подобным образом построены и кристаллы многих боридов, причем ковалентной связью иногда соединяются атомы бора с металлами. Самый термостойкий из всех боридов - диборид гафния HfB2, который плавится только при 3250°С. "Рекордист" по химической стойкости - диборид тантала ТаВ2, на него не действуют никакие кислоты и даже кипящая царская водка.
И, напоследок, о соединениях бора с азотом. Характерно, что сочетание элементов № 5 и 7 по существу дублирует элемент № 6. Известно вещество, которое называют неорганическим бензолом. Сравните две формулы:
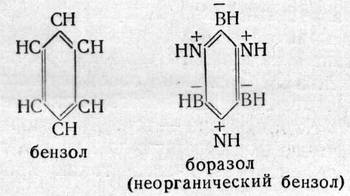
Налицо идентичное строение, близки физические и химические свойства; правда, в большинстве реакций боразол ведет себя активнее бензола.
ВN - таков состав вещества, которое иногда называют белым графитом. Его получают, прокаливая технический бор или окись бора в атмосфере аммиака. Это белый, похожий на тальк порошок, но сходство с тальком чисто внешнее; намного больше и глубже сходство аморфного нитрида бора с графитом. Одинаково построены кристаллические решетки, оба вещества с успехом применяют в качестве твердой высокотемпературной смазки.
После того как в условиях сверхвысоких давлений и высоких температур удалось перестроить кристаллическую решетку графита и получить искусственные алмазы подобную операцию провели и с "белым графитом". Условия опыта, в котором это удалось сделать, были такими: температура 1350°С, давление 62000 атмосфер. Из автоклава вынули кристаллы, внешне совершенно непривлекательные. Но эти кристаллы царапали алмаз. Правда, и он не оставался в долгу и оставлял царапину на кристаллах нитрида бора.
Это вещество назвали боразоном. Хотя твердость алмаза и боразона одинакова, последний имеет два очень значимых для техники преимущества. Во-первых, боразон более термостоек: он разлагается при температурах выше 2000° С, алмаз же загорается при 850°С. Во-вторых, боразон лучше, чем алмаз, противостоит действию ударных нагрузок - он не столь хрупок.
Известное сходство с углеродом проявляет и сам бор, а не только его соединения с азотом. Это не должно удивлять. Бор и углерод - соседи по менделеевской таблице, оба элемента - неметаллы, мало отличаются размеры их атомов и ионов.
Коротко еще об одной причине этого сходства. На внешней электронной оболочке атома бора - на один электрон меньше, чем у атома углерода. Но одна из орбит этой оболочки свободна, и атом бора всегда готов заполучить на нее чужой электрон (поэтому, кстати, бор называют электронодефицитным элементом). При этом образуется так называемая координационная связь между атомом бора и атомом, который предоставил ему свой электрон. Таким образом, бор во многих соединениях выступает как четырехвалентный и становится совсем похожим на углерод; только, конечно, позаимствовав лишний электрон, атом бора приобретает отрицательный заряд. Отсюда берет начало другая ветвь химии бора - его многочисленные комплексные соединения. Главное следствие сходства бора и углерода - быстрое развитие химии бороводородов, которая, по мнению многих ученых, может со временем стать "новой органикой". Напомним, что просто "органика", органическая химия, это по существу химия углеводородов и их производных.
"НОВАЯ ОРГАНИКА"
Первые соединения бора с водородом получены П. Джонсом и Л. Тейлором еще в 1881 году. Долгое время охотников заниматься этими соединениями было немного. Бороводороды (или бораны) нестойки, ядовиты, они скверно пахнут и, главное, очень странно построены. Попробуйте определить, какую валентность проявляет бор в таких, например, соединениях: В2Н6, В4Н10, В5Н9, В10Н14.
Строение некоторых бороводородов можно было объяснить образованием полимерных цепочек из атомов бора. Но тогда эти соединения должны были бы обладать большой стабильностью, а они, наоборот, разлагаются от малейшего воздействия. Значит, нужно другое объяснение их структуры.
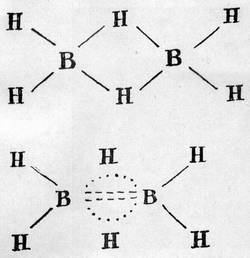
Так построена молекула простейшего из бороводородов - диборана.
Важную роль в таких соединениях играют так называемые трехцентровые связи, когда два электрона находятся в поле не двух, как обычно, а трех ядер, так. что все три атома оказываются связанными общим электронным облаком. (Они показаны в формуле внизу пунктирами.) Это одно из следствий электронодефицитности бора
Картина стала проясняться лишь в конце 40-х - начале 50-х годов нашего века. Одной из причин, по которой во многих странах химики усиленно занялись бороводородами и их производными, был интерес к этим веществам, проявленный военными ведомствами.
Дальность и скорость полета летательных аппаратов (неважно, самолет это или ракета) во многом зависят от теплоты сгорания применяемого горючего. Энергетический "потолок" любого углеводородного топлива не превышает 10,5 тысяч килокалорий на килограмм, потому что теплотворная способность самого углерода сравнительно невелика - 7800 ккал/кг.
Замена углерода более "калорийными" элементами позволяет получать топлива со значительно лучшими энергетическими характеристиками. Теплота сгорания бора - 14170 ккал/кг - почти вдвое больше, чем у углерода. Когда стали подсчитывать, что может дать замена углеводородных топлив бороводородными, то оказалось, что реактивная авиация может выиграть от такой замены очень многое. Во-первых, при заданной дальности полета можно уменьшить габариты самолета, соответственно увеличив его скорость. Во-вторых, можно увеличить полезную нагрузку. В-третьих, - сократить разбег при взлете.
Разумеется, новейшие сведения о бороводородных топливах засекречены, поэтому придется довольствоваться примерами почти десятилетней давности.
Уже в начале 60-х годов были известны американские топлива типа НЕF. Это производные бороводородов, в которых некоторые атомы водорода заменены органическими радикалами (этил, бутил и т. д.). Теплота сгорания у них меньше, чем у чистых боранов, но зато они менее ядовиты и более стабильны.
Испытания первых бороводородных топлив были не совсем удачными. Топлива, которые при сгорании дают твердые остатки, опасны для любой техники, особенно для реактивной: возможна забивка сопел, чреватая опасностью взрыва. Если же твердые вещества образуются из-за недостаточной стабильности топлива прежде, чем оно успеет сгореть, то возможны нарушения работы системы подачи горючего и других узлов двигателя.
После стендовых испытаний турбореактивного двигателя, работавшего на бороводородном топливе, были обнаружены отложения окиси бора на статоре и роторе турбины, на всех деталях форсажной камеры, на выходном сопле. Взрыва не было, но он мог быть.
Успешнее оказались испытания бороводородных топлив в воздушно-реактивных двигателях, предназначенных для управляемых снарядов. С переводом на новое топливо летно-технические данные этих снарядов существенно улучшились.
Можно предполагать, что за десять лет, прошедших со времени описанных испытаний, многие трудности того времени удалось преодолеть. Химия бороводородов и их производных развивается быстро. В частности, в эти годы синтезированы барен и необарен - вещества состава В10Н10(СН)2. Друг от друга они отличаются только взаиморасположением составляющих атомов. В отличие от боранов, барены отличаются значительной термической и химической стойкостью. Барен выдерживает нагревание до 500°С, не растворяется в щелочах и спиртах, не окисляется под действием большинства окислителей...
Конечно, интерес к бороводородам и их производным объясняется не только возможностью использования их в качестве топлива. Член-корреспондент Академии наук СССР Б. В. Некрасов утверждает, что "химия бороводородов и их производных по своему характеру и богатству синтетических возможностей приближается к органической химии". Подобного мнения придерживаются и многие другие специалисты.
"Новая органика" только начинается. Органика на основе бора. И это еще одно подтверждение большого будущего элемента № 5.
Что вы знаете и чего не знаете о боре и его соединениях
ПОРАЗИТЕЛЬНЫЙ ИНДИВИДУАЛИЗМ
Бор не относится к числу самых распространенных элементов земной коры, на его долю приходится лишь 3-10-4% от ее веса. Несмотря на это, известно больше 80 собственных минералов бора, а в "чужих" минералах этот элемент почти не встречается. Это объясняют прежде всего тем, что у комплексных анионов бора (а именно в таком виде он входит в большинство минералов) нет достаточно распространенных аналогов. Известно, что почти во всех минералах бор связан с кислородом - группа фторсодержащих соединений совсем малочисленна. Главные минералы бора - бура Na2B4O7·10H2O, кернит Na2B4O7·4Н2О и сассолин (или борная кислота), а также магниевый боросиликат датолит. Самые крупные месторождения борного сырья находятся в ГДР, СССР и США.
БОРНЫЕ УДОБРЕНИЯ
Для многих живых организмов бор - жизненно важный элемент. Вместе с марганцем, медью, молибденом и цинком он входит в число пяти важнейших микроэлементов. При недостатке бора в почве заметно уменьшаются урожаи многих культур, причем особенно сильно нехватка бора сказывается на урожае семян. Установлено, что бор влияет на углеводный и белковый обмен в растениях. Вместе с урожаем культурных растений с каждого гектара почвы ежегодно уходит до десяти граммов бора. Особенно активно уносят его корнеплоды и кормовые травы. Эту естественную убыль приходится восполнять, внося в почву борные удобрения. В качестве борных удобрений чаще всего применяют бораты магния, борнодатолитовое удобрение, содержащее до 14,5% водорастворимой борной кислоты, и суперфосфат с добавками соединений бора. Их вносят под многолетние травы, лен, хлопчатник, овощные, плодово-ягодные и многие другие культуры. Эффект от применения борных удобрений во много раз превосходит затраты на их производство и внесение в почву.
НЕ ОБЪЯСНЕННОЕ СВОЙСТВО
Известно, что электропроводность всех без исключения металлов и большинства неметаллов с ростом температуры уменьшается. У бора - наоборот. При обычных условиях он плохо проводит ток и по существу является изолятором. Но при повышении температуры электропроводность бора начинает расти. При 600°С она уже в 100 раз больше, чем при нормальной температуре. Это необычное свойство пока не объяснено наукой.
ПРИЧИНЫ ПРЕВОСХОДСТВА
Бор - не единственный элемент, хорошо поглощающий тепловые нейтроны, образующиеся при цепной ядерной реакции. Большей, чем у бора, способностью к захвату нейтронов обладают шесть элементов: самарий, европий, гадолиний, диспрозий, плутоний (изотопы Рu239 и Рu241) и кадмий. Но перед каждым из них у бора есть преимущества. Он стабилен, термостоек, не ядовит и достаточно распространен. Кадмий же плавится уже при 321° С, к тому же он токсичен. Плутоний не только токсичен, но и радиоактивен. И очень дорог. Остальные четыре элемента - лантаноиды, они крайне редки и рассеяны, разделять их очень сложно. Так что практически "конкурентом" бора при изготовлении регулирующих систем атомных реакторов может быть только кадмий, да и то не всегда.
БОР - ЛЕГИРУЮЩИЙ ЭЛЕМЕНТ
В сплавы цветных и черных металлов бор обычно вводят для повышения их износостойкости и жаропрочности. Минимальные добавки бора к стали (0,0005-0,005%) увеличивают глубину ее закалки, а следовательно, и прочность. Бор лучше любого другого элемента очищает медь от растворенных в ней газов, после легирования бором свойства меди значительно улучшаются. Вдобавок насыщение поверхности многих металлов бором приводит к образованию боридов этих металлов - соединений твердых и прочных.
КИСЛОТЫ СИЛЬНЫЕ И СЛАБЫЕ
Борная кислота - одна из немногих кислот, которую можно назвать минеральной в полном смысле этого слова: она встречается в земной коре. А по химическим свойствам это одна из самых слабых кислот. При нагревании выше 100°С кислота состава Н3ВО3 теряет молекулу воды и превращается в тоже очень слабую метаборную кислоту НВО3. Но не всем кислотам бора свойственна слабость. Комплексная фтороборная кислота НВF4 - продукт присоединения НF к ВF3 - сильнее плавиковой, серной и азотной кислот.
Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки
Помоги сайту! Брось денежку в смс-копилку!