 | Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки |
Архив статей > Химия > Аммиак - антипод и аналог воды
Аммиак - антипод и аналог воды
И. Ильин
Химия и Жизнь №12, 1985 г., с. 24-28
Запах этого газа знаком каждому - даже тем, кто совсем далек от химии. Кое-что о его свойствах тоже всем известно (учат в школе). Известно и то, что сегодня аммиак - один из многотоннажных продуктов основной химии: именно в него в промышленных условиях проще всего превратить неохотно вступающий в реакции азот воздуха. С этого превращения и начинают свой путь многочисленные азотсодержащие соединения: всевозможные нитраты и нитриты, анилиновые красители и взрывчатые вещества, полимерные материалы и лекарственные средства...
Когда человек познакомился с аммиаком?
Если следовать формальной логике построения истории веществ и элементов, то за точку отсчета нужно брать опыт великого английского химика XVIII в. Дж. Пристли, который первым получил чистый аммиак, нагревая нашатырь NH3Cl с гашеной известью Са(ОН)2. Выделявшийся "щелочной воздух" Пристли собирал над ртутью. Спустя 11 лет, в 1784 г., знаменитый К. Бертолле установил элементный состав этого газа, который в 1787 г. получил официальное название "аммониак". Это название сохраняется и ныне в большинстве западно-европейских языков (нем. Ammoniak, англ, ammonia, фр. ammoniaque); сокращенное название "аммиак", которым мы пользуемся, ввел в обиход русский химик Я. Д. Захаров в 1801 г.
Впрочем, у этой истории, несомненно, есть и предыстория. Так, за сто лет до Пристли его соотечественник Роберт Бойль наблюдал, как "дымится" палочка, смоченная соляной кислотой и подставленная под струю пахучего газа, образующегося при сжигании навоза... Но и Бойль вряд ли был первым исследователем еще не открытого аммиака. Ведь получали-то его и раньше, а водный раствор аммиака - нашатырный спирт чуть ли не с древних времен использовали как слабую щелочь при обработке и окраске шерсти.
К началу прошлого века аммиачную воду получали уже в значительных количествах в качестве побочного продукта при производстве осветительного газа из каменного угля. Однако для промышленности получаемого таким способом аммиака явно нехватало, поэтому были разработаны чисто химические методы его синтеза, например из цианамида кальция:
CaCN2 + 3H2O =(100°С)= 2NH3 + CaCO3
или из цианида натрия:
NaCN + 2H2O =(500°C)= HCOONa + NH3.
Как видим, в первых промышленных процессах аммиак, подобно ацетилену, получался при непосредственном участии воды. Эти методы долгое время считались перспективными, поскольку исходные вещества получали из доступного сырья.
В 1901 г. французский химик Ле Шателье взял патент на способ получения аммиака из азота и водорода в присутствии катализатора. Однако до промышленного использования этого процесса было еще далеко: лишь в 1913 г. заработала первая промышленная установка, созданная немецкими химиками Ф. Габером и К. Бошем. Впоследствии оба они (хотя и с интервалом в 13 лет) были удостоены Нобелевской премии по химии.
Об усилиях, затраченных на поиски наиболее эффективной технологии, свидетельствует такой факт: с 1903 по 1919 г. в качестве катализатора синтеза аммиака было испытано 4000 различных веществ! Очень хорошо зарекомендовал себя осмий, одно плохо - он заметно дороже золота и платины. Поэтому сейчас в колоннах синтеза аммиака работает дешевый, но достаточно эффективный катализатор - губчатое железо с примесями оксидов калия и алюминия. Так что практически все атомы азота, входящие в состав множества веществ - от аммофоса до амидопирина, побывали когда-то на железном катализаторе.
ГАЗООБРАЗНЫЙ АММИАК И ЕГО ВОДНЫЕ РАСТВОРЫ
Молекулу NH3 можно представить в виде трехгранной пирамиды с атомом азота в вершине. Однако в отличие от пирамиды, склеенной, к примеру, из бумаги, молекула NH3 способна с легкостью вывертываться наизнанку, наподобие зонтика, и при обычных условиях она проделывает такое превращение с огромной частотой - 23 миллиарда 870 миллионов раз в секунду. Это превращение называется инверсией и вызвано квантово-химическим эффектом. Существование инверсии доказывается чисто логически: не будь ее, можно было бы синтезировать оптические изомеры замещенных производных аммиака. Однако такие изомеры не обнаружены.
Аммиак химически довольно активен; в чистом кислороде он сгорает бледно-желтым пламенем, превращаясь в основном в азот и воду. В присутствии катализаторов при окислении аммиака образуются оксиды азота. Если в смесь аммиака с воздухом ввести свечу, то она продолжает гореть, пламя даже увеличивается.
Известно, что вода обладает аномально высокими (для гидридов элементов VI группы) температурами плавления и кипения.
То же и аммиак: его температуры плавления (-77,8°С) и кипения (-33,4°С) значительно выше, чем у ближайшего аналога по V группе - фосфина РН3 (-133,8 и - 87,4°С соответственно). Причина та же, что и в случае воды,- относительно прочные водородные связи между молекулами. При плавлении аммиака рвутся только 26 % всех его водородных связей, еще 7% разрываются при нагреве жидкости до температуры кипения. И лишь выше этой температуры исчезают почти все оставшиеся между молекулами связи. Именно наличием большого числа водородных связей в жидком аммиаке объясняется довольно высокая теплота его испарения - 23,3 кДж/моль. (И эта величина значительно больше, чем у фосфина - 14,6 кДж/моль, но заметно меньше теплоты испарения воды - 44 кДж/моль.)
Среди прочих газов аммиак выделяется огромной растворимостью в воде: при нормальных условиях миллилитр воды способен поглотить больше литра аммиака! Поэтому водные растворы аммиака обладают уникальным среди всех щелочей свойством: их плотность снижается с увеличением концентрации раствора (от 0,99 г/см3 для 1 %-ного раствора до 0,89 г/см3 для 30 %-ного). В то же время "выгнать" аммиак из водного раствора довольно легко. При одном условии: над раствором не должно быть избыточного давления самого же аммиака. Поэтому даже разбавленные растворы имеют отчетливый резкий запах "нашатырного спирта", а при хранении в неплотно закупоренной посуде достаточно быстро "выдыхаются". Полностью удалить аммиак из воды можно даже непродолжительным кипячением.
На высокой растворимости аммиака в воде основан красивый демонстрационный опыт - цветной фонтан в колбе, наполненной аммиаком (см. рис.). "Пусковым устройством" служит пипетка с водой: нескольких капель воды, впрыснутых в колбу, достаточно для растворения значительных количеств газа. В результате в колбе создается разрежение, и под действием атмосферного давления вода с растворенным в ней индикатором (фенолфталеином) устремляется в колбу. Там она тут же окрашивается в малиновый цвет - из-за образования щелочного раствора.
Слабую щелочь - водный раствор аммиака - в химической литературе часто называют гидроксидом аммония. Однако это название не совсем правильное, поскольку в водном растворе NH4OH диссоциирует нацело и, по-видимому, вообще не существует в виде недиссоциированных молекул. В то же время если сильно охладить (примерно до -80°С) водный раствор аммиака, то можно получить гидраты состава NH3·H2O и 2NH3·H2O. Растворимость аммиака в воде при нормальных условиях (1170 мл на 1 мл воды) как раз соответствует соотношению NH3·H2O. Значит, в насыщенном растворе каждая молекула воды удерживает одну молекулу аммиака.
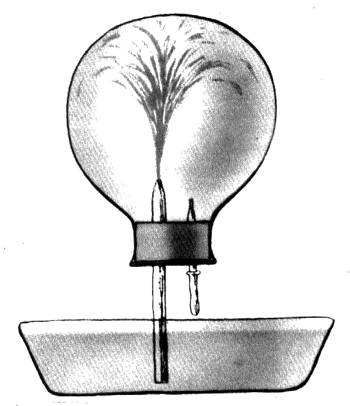
Чрезвычайно высокая растворимость аммиака в воде - основа эффектного опыта. Колба наполнена аммиаком при нормальном давлении. Нескольких капель воды, впущенных в колбу через пипетку, достаточно, чтобы в колбе создалось разрежение. Вода с растворенным в ней фенолфталеином (классическим индикатором) устремляется в колбу. Щелочной фонтан, естественно, оказывается малинового цвета
АММИАК В КОМПЛЕКСАХ
Рассказывая об аммиаке, нельзя не упомянуть о его роли в комплексных соединениях, которых известно огромное множество. В отличие от классических амино-соединений R-NH2 в этих комплексах с азотом всегда связаны три атома водорода, и в их названии удваивается "м" (аммино-комплексы или аммиакаты).
Как и в случае воды, комплексообразование с аммиаком часто сопровождается изменением окраски вещества. Так, белый порошок сульфата меди при растворении в воде дает голубой раствор медного купороса в результате образования аквакомплекса [Сu(Н2О)6]2+. А при добавлении аммиака этот раствор окрашивается в красивый сине-фиолетовый цвет, поскольку образуется амминокомплекс [Cu(NH3)4(H2O)2]2+. Аналогично безводный хлорид никеля (II) имеет золотисто-желтый цвет, кристаллогидрат [Ni(Н2О)6]Сl2 - зеленый, а аммиакат [Ni(NH3)6]Cl2 - светло-голубой. Твердый комплекс аммиака с хлоридом серебра М. Фарадей использовал для сжижения аммиака. Фарадей нагревал это вещество в одном колене запаянной стеклянной трубки. А в другом колене, помещенном в охлаждающую смесь, собирался под давлением аммиак. И превращался в жидкость.
Некоторые аммиакаты проявляют довольно необычные свойства. Так, если заполнить аммиаком колбу с сухой белой солью - роданидом аммония NH4NCS, то при охлаждении соль "растает", превратится в жидкость. Эту жидкость, содержащую до 45% аммиака, можно хранить в склянке с притертой пробкой и использовать в качестве своеобразного аммиачного источника. Заметим, что некоторые соли, образующие кристаллогидраты, аналогично ведут себя по отношению к воде: например, кристаллический хлорид цинка на воздухе постепенно "расплывается" и превращается в конце концов в вязкую жидкость. Гигроскопичны и многие другие неорганические соли.
НЕОБЫЧНЫЕ СВОЙСТВА ЖИДКОГО АММИАКА
И внешне жидкий аммиак похож на простую воду. Сходство этим не ограничивается. Практически важно, что, как и вода, аммиак - прекрасный растворитель многих неорганических и органических соединений. В нем, в частности, легко растворяются многие соли, и как в водных растворах, растворяясь, диссоциируют на ионы. Конечно, катионы металлов в таких растворах сольватированы молекулами аммиака.
В то же время многие реакции с участием солей идут в жидком аммиаке совсем не так, как в воде. Прежде всего, потому, что разные соли по-разному растворяются в аммиаке и в воде (см. таблицу):
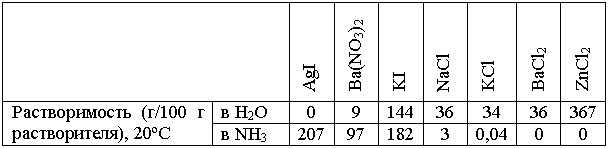
Из этих данных следует, например, что в жидком аммиаке ничего не стоит провести некоторые обменные реакции, немыслимые в водных растворах:
Ba(NO3)2 + 2AgCl = BaCl2 + 2AgNO3.
Молекула NH3 - сильный акцептор протонов. Поэтому, если растворить в аммиаке уксусную кислоту, то эта обычно слабая кислота продиссоциирует нацело, проявив тем самым свойства кислоты сильной. В жидком аммиаке по сравнению с водными растворами значительно усиливаются и кислотные свойства солей аммония. Здесь легко идут такие, к примеру, реакции 2NH4NO3 + Mg = Mg(NO3)2 + 2NH3 + H2 или Na2O2 + 2NH4NO3 = 2NaNO3 + H2O2 + 2NH3.
Из растворов различных веществ в жидком аммиаке наиболее интересны, без сомнения растворы щелочных металлов. Впервые аммиачные растворы натрия и калия были приготовлены больше века назад (в 1864 г.) и сразу же обратили на себя внимание химиков. Они прежде всего установили, что если дать аммиаку спокойно испариться, в осадке останется чистый металл, как это бывает с растворами солей в воде. Однако эта аналогия не совсем точна: щелочные металлы, хотя и медленно, с аммиаком все же реагируют с выделением водорода и образованием солеобразных амидов: 2К + 2NH3 = 2KNH2 + H2. Амиды - вполне устойчивые соединения, но водой немедленно разлагаются: KNH2 + H2O= NH3 + KOH.
Тогда же выяснилось, что при растворении металла в жидком аммиаке объем раствора увеличивается. При этом с ростом концентрации металла непрерывно снижается плотность раствора, чего не бывает у водных растворов твердых веществ. Концентрированный раствор лития в жидком аммиаке - вообще самая легкая при обычных условиях жидкость: ее плотность при 20°С составляет всего 0,48 г/см3; она вдвое легче воды, легче спирта, бензина, эфира...
Вообще свойства растворов щелочных металлов в жидком аммиаке сильно зависят от концентрации. В разбавленных растворах находятся катионы металла и самые легкие анионы - электроны, которые, однако, не могут свободно передвигаться, так как они связаны с молекулами аммиака. Именно такие связанные (сольватированные) электроны придают растворам щелочных металлов в жидком аммиаке красивый синий цвет. Сольватированные электроны можно получить и в водном растворе, но при обычных условиях время их жизни в воде чрезвычайно мало. В аммиаке - куда больше.
Сильно разбавленные аммиачные растворы плохо проводят электрический ток. Но с ростом концентрации растворенного металла несвязанных электронов становится в растворе все больше - электропроводность очень сильно повышается, иногда в триллионы раз, от 10-8 (что типично для диэлектриков) до 104 Ом-1см-1 (что приближается уже к электропроводности металлов). Вообще разбавленные растворы щелочных металлов в жидком аммиаке настолько отличаются от концентрированных, что трудно поверить, что это раствор одного и того же вещества в одном и том же растворителе. Разбавленный и концентрированный растворы одного и того же щелочного металла в жидком аммиаке не смешиваются друг с другом! Для водных растворов это - редкое явление.
Растворы с концентрацией более 3 моль/л называют иногда жидкими металлами, поскольку им присущ отчетливый металлический блеск с золотисто-бронзовым отливом. Это свойство сохраняется и когда раствор замораживают. Кстати, и здесь литию принадлежит своеобразный рекорд: его концентрированный раствор в жидком аммиаке - самый легкоплавкий "жидкий металл", он замерзает лишь при температуре ожижения кислорода -183°С.
Много ли металла может растворить жидкий аммиак? Это зависит в основном от температуры. При температуре кипения моль аммиака способен растворить примерно 0,15 моль щелочного металла. С ростом температуры растворимость быстро увеличивается и становится бесконечно большой при температуре плавления металла (для цезия это происходит уже при 28°С). Аммиак из таких растворов испаряется слабо, так как давление его насыщенных паров над раствором при увеличении концентрации металла стремится к нулю. Общепринятой теории, которая объясняла бы все особенности поведения растворов металлов в жидком аммиаке, пока нет. Экспериментаторы же обнаруживают все новые факты. Оказалось, например, что сопротивление замороженного раствора натрия в жидком аммиаке крайне мало. Растворы металлов в аммиаке использовали для получения сверхпроводящих систем. Не удивительно поэтому, что и в наши дни растворами металлов в аммиаке с большим интересом занимаются как химики, так и физики. И те и другие находят в аммиаке и его растворах предмет для размышлений и приложения рук.
Что вы знаете и чего не знаете об аммиаке
АММИАК В АТМОСФЕРЕ
Как известно, в воздухе всегда есть водяные пары - благодаря интенсивному испарению с поверхности морей и океанов в атмосфере содержится до 4% воды. А как обстоит дело с аммиаком? Не исключено, что на ранних стадиях эволюции Земли в ее атмосфере было довольно много аммиака.
Однако и сейчас ничтожные количества этого газа всегда можно обнаружить в воздухе, поскольку аммиак непрерывно образуется при разложении белков. На некоторых планетах Солнечной системы ситуация иная: астрономы считают, что значительная часть масс Юпитера и Сатурна приходится на твердый аммиак.
АММИАК ИЗ УГЛЯ
Уголь состоит главным образом, конечно, из углерода, но и другие элементы, в том числе водород и азот, в нем тоже есть. Они взаимодействуют в процессах пиролиза. Поэтому и получали когда-то аммиак из угля. Не много по нынешним меркам. В прошлом веке на газовых заводах при нагревании без доступа воздуха тонны хорошего каменного угля получали до 700 кг кокса и около 200 кг (300 тысяч литров) газообразных продуктов пиролиза. Их охлаждали и пропускали через воду. При этом получали примерно 50 кг дегтя и 40 кг аммиачной воды. Оставшийся светильный газ состоял в основном из окиси углерода (8%), водорода (45%) и метана (35%) с небольшими примесями других углеводородов, азота и углекислого газа.
ОПАСЕН ЛИ АММИАК?
Медики используют аммиак в повседневной практике: вспомните ватку, смоченную в нашатырном спирте, к которой прибегают в различных сложных ситуациях. Для пациента это не опасно, хотя аммиак заслуженно считается токсичным газом. К счастью, человек способен почувствовать запах аммиака в воздухе уже в ничтожной концентрации - 0,0005 мг/л, когда еще нет большой опасности для здоровья. Если же его концентрация в 100 раз больше, проявляется раздражающее действие аммиака на слизистую оболочку глаз и верхних дыхательных путей. Возможна даже рефлекторная остановка дыхания. Концентрацию 0,25 мг/л с трудом выдерживает в течение часа даже очень здоровый человек. Еще более высокие концентрации вызывают химические ожоги глаз и дыхательных путей, становятся опасными для жизни. Признаки отравления аммиаком могут быть весьма необычными. У пострадавших, например, изменяется так называемый слуховой порог: даже не очень громкие звуки становятся невыносимыми, могут вызвать судороги. Отравление аммиаком может вызвать у человека сильное возбуждение, вплоть до буйного бреда. Очевидно, аммиак способен поражать жизненно важные центры, так что при работе с ним надо соблюдать те же меры предосторожности, что и при работе с другими ядовитыми газами.
СЖИЖЕННЫЙ ГАЗ
Теплота испарения жидкого аммиака в 4 раза больше, чем у жидкого азота, и в 200 раз больше, чем у жидкого гелия. Поэтому жидкий гелий вообще невозможно налить в обычный стакан - при такой операции он непременно испарится. С жидким азотом такую операцию провести можно, но значительная его часть испарится, охлаждая сосуд, а оставшаяся жидкость выкипит довольно быстро. Поэтому обычно сжиженные газы в лабораториях хранят в специальных сосудах с двойными стенками, между которыми вакуум,- сосудах Дьюара. Жидкий аммиак, в отличие от других газов, можно держать в обычной химической посуде - стаканах, колбах, он и при этом испаряется не слишком быстро. Если же налить его в сосуд Дьюара, то там он может храниться очень долго. При комнатной температуре давление пара над жидким аммиаком составляет примерно 10 атм, поэтому при длительных экспериментах с ним можно работать в запаянных стеклянных ампулах, которые такое давление выдерживают. Большая теплота испарения жидкого аммиака не только облегчает работу с ним как с растворителем, но и позволяет использовать аммиак в качестве основного хладагента в разнообразных холодильных установках.
КАК СДЕЛАТЬ "РЕЗИНОВОЕ" ДЕРЕВО
Еще один эффектный опыт с аммиаком - "резиновое" дерево. Древесина, как известно, состоит в основном из целлюлозы, макромолекулы которой расположены параллельно и соединены между собой многочисленными водородными связями. Жидкий аммиак легко разрушает эти водородные мостики, в результате молекулы целлюлозы приобретают способность скользить относительно друг друга. Поэтому, если деревянную палочку опустить на некоторое время в жидкий аммиак, то после того как она им как следует пропитается, палочку можно гнуть как угодно и даже сворачивать в спираль. Но не надолго. Аммиак вскоре испарится, водородные связи восстановятся (хотя уже в других местах), и палочка вновь станет жесткой, сохранив при этом форму, которую ей придали в жидком аммиаке.
Главная :: Архив статей :: Поиск :: Гостевая :: Внешняя :: Ссылки
Помоги сайту! Брось денежку в смс-копилку!